卵巢癌基因变异与靶向药物
1卵巢癌概述
卵巢癌为最常见的妇科恶性肿瘤之一。中国2015年预计的卵巢癌发病人数为52,100例,位于妇科恶性肿瘤第三位;死亡人数为22,500例,位于妇科恶性肿瘤第二位。目前卵巢癌的治疗还是以手术和化疗为主,但对于复发和难治性卵巢癌尚无很好的治疗方案。卵巢癌中有很多基因存在变异,针对突变基因的靶向治疗可能为卵巢癌患者带来更多益处。
2卵巢癌基因变异概况
1. 浆液性卵巢癌
约90%的卵巢癌为上皮性卵巢癌,其余为卵巢生殖细胞肿瘤,性索间质肿瘤等非上皮性肿瘤。上皮性卵巢癌包括浆液性卵巢癌,粘液性卵巢癌,透明细胞性卵巢癌和子宫内膜样卵巢癌。
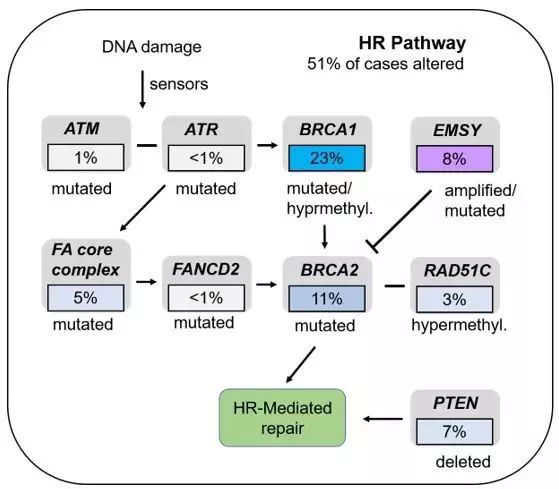
浆液性卵巢癌在上皮性卵巢癌中约占70%,其中大于90%为高级别浆液性腺癌(high‑grade serous ovarian cancer, HGSOC)。TCGA(The Cancer GenomeAtlas)对489名HGSOC患者进行基因分析发现约96%的患者存在TP53突变[1]。有文献将TP53的突变归为3类:明确致癌突变、功能缺失突变和意义未明突变[2]。按此划分在HGSOC中TP53的明确致癌突变约占21%,意义未明突变约占59%。此外,TCGA 的数据显示还有约22%的病例存在BRCA1/2突变。BRCA突变与同源重组修复缺陷(homologous recombination deficient, HRD)有关,文献报道BRCA突变会导致约一半的细胞出现HRD。其他同源重组修复(homologous recombination,HR)通路相关基因也在HGSOC中存在变异,如EMSY(8%),PTEN(7%),RAD51C(3%),ATM/ATR(2%)。总的来说在HGSOC有约50%的患者存在HR通路的改变。
除了基因突变,在HGSOC患者中还存在大量的DNA拷贝数变异。TCGA数据表明有超过一半的HGSOC患者存在DNA拷贝数异常,涉及到的基因有CCNE1,MYC,MDS1等。这些扩增的基因主要涉及RB通路,PI3K/AKT通路,NOTCH通路和FOXM1通路。
与HGSOC不同,低级别浆液性卵巢癌(low‑grade serous ovariancancer, LGSOC)中TP53通常是野生型的,而主要突变基因是KRAS和BRAF,约占65%[3]。在某些病例中BRAF突变与KRAS突变不同时发生,提示KRAS和BRAF在激活MAPK信号通路上存在互补功能。在HGSOC中突变累及的细胞生长通路是PI3K/AKT通路而在LGSOC中累及的是RAS/RAF/MAPK通路,这提示浆液性卵巢癌的恶性转化与生长通路的转化有关。
▲ HR通路基因在HGSOC中的变异情况[1]
2. 其他类型的上皮性卵巢癌
粘液性卵巢癌(Mucinous ovariancarcinoma , MOC)在卵巢癌中约占12%。与其他类型的卵巢癌不同,MOC的发生与BRAC1/2的胚系突变不相关,其最常见的基因变异是KRAS突变和HER2扩增[4]。
透明细胞卵巢癌(ovarian clear cellcarcinoma, OCCC)在卵巢癌中约占8%。主要突变基因是PIK3CA和ARID1A,其中PIK3CA突变约占33%[5,6]。ARID1A基因编码产物参与调控核小体的结构并调节DNA结合蛋白。因此,ARID1A突变会导致DNA转录,复制和修复功能异常,进而导致细胞癌变。
子宫内膜样卵巢癌(endometrioid ovariancarcinoma, EOC)比例很少,高级别的EOC突变基因主要是PTEN,ARID1A, PIK3CA和CTNNB-1;低级别EOC主要是BRAC1/2的胚系突变[7]。
表 2.1 HGSOC和OCCC基因突变频率比较[8]
|
Gene name |
HGSOC, % |
OCCC, % |
|
ARID1A |
0 |
57 |
|
TP53 |
96 |
52 |
|
BRCA |
22 |
6 |
|
KRAS |
0 |
14 |
|
PIK3 |
<10 |
33 |
3卵巢癌的靶向用药
按照TP53的突变情况可以把卵巢癌分为两类,TP53高频突变卵巢癌和TP53低频突变卵巢癌。低频突变卵巢癌包括LGSOC,OCCC,LGEOC和MOC;高频突变主要是HGSOC。按TP53突变状态分类有利于卵巢癌的诊断和治疗。目前没有直接针对TP53的靶向药物,阿斯利康在研药物AZD1775对铂类敏感的 TP53突变的卵巢癌有效,其原理是TP53缺失的细胞在接受基因毒性药物 WEE1 抑制剂 AZD1775治疗时出现协同致死。发表于JCO的一项研究表明,AZD1775联合卡铂对于TP53突变的、一线铂类为基础的化疗耐药或无效的(<3个月)卵巢癌疗效明显。结果发现,AZD1775联合卡铂的毒性反应在可控范围内,最常见的不良事件包括:乏力(87%),恶心(78%),血小板减少(70%),腹泻(70%),呕吐(48%)。最常见的3/4级不良事件包括:血小板减少(48%)和中性粒细胞减少(37%)。在招募的24例患者中,21例适合评估效价终点。总体缓解率是43%(95% CI, 22%-66%),包括一例延长的完全缓解。中位无进展生存和总体生存分别为5.3个月(95% CI ,2.3-9.0)和12.6个月(95% CI ,4.9-19.7)。有2例患者在数据截止时保持缓解状态超过31个月和42个月[9]。
针对存在HRD的患者可以利用PARP抑制剂治疗。目前FDA批准的应用于卵巢癌治疗的PARP抑制剂有奥拉帕尼(Olaparib)、瑞卡帕尼(Rucaparib)和尼拉帕尼(Niraparib)。奥拉帕尼获批治疗携带BRCA胚系有害突变的经过三线及以上化疗的晚期卵巢癌,瑞卡帕尼获批治疗携带BRCA胚系或体细胞突变的经过二线及以上化疗的晚期卵巢癌,尼拉帕尼获批用于复发性上皮性卵巢癌的维持治疗。奥拉帕尼也在欧洲药品管理局(europeanmedicines agency,EMA)获批,但获批适应症与FDA稍有不同。EMA批准奥拉帕尼用于携带BRAC体细胞或胚系突变的铂敏感复发性高级别浆液性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。虽然目前三种药物均未在中国上市,但奥拉帕尼目前正在中国开展III期临床试验,相信不久之后就会与中国患者见面。除了已经获批的PARP抑制剂,国内外还有很多PARP抑制剂处在临床试验阶段。如Medivation公司的Talazoparib,目前处于II期临床实验中;国内处于领先的为百济神州的BGB-290,已经在澳洲临床试验中展现了不错的疗效。
PI3K/mTOR抑制剂对于HGSOC的治疗可能有效,目前国内外多家公司都有以PI3K/mTOR为靶点的在研药物,但目前都还处于I期临床试验阶段。对于以KRAS/BRAF突变为主的LGSOC,可选用可靶向RAF的多靶点抑制剂瑞戈非尼和靶向下游分子MEK的曲美替尼,目前这些药物处于II期临床试验阶段。
表 3.1 卵巢癌的临床试验靶向药物
|
药物 |
靶点 |
阶段 |
相关基因 |
|
AZD1775 |
WEE1 |
II期 |
TP53 |
|
瑞戈非尼 |
RAF |
II期 |
BRAF |
|
曲美替尼 |
MEK |
II期 |
BRAF/KRAS |
|
Perifosine |
AKT/PI3K |
I期 |
PTEN/PIK3CA/AKT1/AKT2 |
|
Triciribine |
AKT |
I期 |
PTEN/PIK3CA/AKT1/AKT2 |
|
Gedatolisib |
PI3K/mTOR |
I期 |
PTEN/PIK3CA/AKT1/AKT2 |
|
BKM120 or BYL719 |
PI3K |
I期 |
PTEN/PIK3CA/AKT1/AKT2 |
4结语
卵巢癌达到临床痊愈者在停止治疗后,大约50% ~ 80%的患者会出现不同程度的复发,对于复发或者难治性卵巢癌传统治疗方法效果不佳。约一半的HGSOC存在HRD,其中30%携带BRCA变异,少数卵巢癌携带KRAS/BRAF突变。携带BRCA变异的患者可以从PARP抑制剂治疗中获益,携带BRAF突变的患者也可应用已在其他癌种获批的靶向BRAF的药物。因此,准确分析卵巢癌患者的基因变异情况对于复发或者难治性卵巢癌的治疗很关键。NGS可以准确分析卵巢癌患者基因变异情况,为卵巢癌患者提供更多的治疗机会。
参考文献
[1] Cancer Genome Atlas Research Network. Integrated genomicanalyses of ovarian carcinoma. Nature 2011, 474:609-615.
[2] Brachova P., Mueting S. R., Carlson M. J. et al. TP53oncomorphic mutations predict resistance to platinum and taxanebased standardchemotherapy in patients diagnosed with advanced serous ovarian carcinoma.International journal of oncology 2015, 46:607-618.
[3] Singer G., Oldt R., 3rd, Cohen Y. et al. Mutations inBRAF and KRAS characterize the development of low-grade ovarian serouscarcinoma. Journal of the National Cancer Institute 2003, 95:484-486.
[4] Kelemen L. E., Lawrenson K., Tyrer J. et al. Genome-widesignificant risk associations for mucinous ovarian carcinoma. Nat Genet 2015,47:888-897.
[5] Wiegand K. C., Shah S. P., Al-Agha O. M. et al. ARID1Amutations in endometriosis-associated ovarian carcinomas. N Engl J Med 2010,363:1532-1543.
[6] Kuo K. T., Mao T. L., Jones S. et al. Frequent activatingmutations of PIK3CA in ovarian clear cell carcinoma. The American journal ofpathology 2009, 174:1597-1601.
[7] Ledermann J. A., Drew Y., Kristeleit R. S. Homologousrecombination deficiency and ovarian cancer. Eur J Cancer 2016, 60:49-58.
[8] Iijima M., Banno K., Okawa R. et al. Genome-wide analysisof gynecologic cancer: The Cancer Genome Atlas in ovarian and endometrialcancer. Oncology letters 2017, 13:1063-1070.
[9] Leijen S., van Geel R. M., Sonke G. S. et al. Phase IIStudy of WEE1 Inhibitor AZD1775 Plus Carboplatin in Patients With TP53-MutatedOvarian Cancer Refractory or Resistant to First-Line Therapy Within 3 Months.Journal of clinical oncology: official journal of the American Society ofClinical Oncology 2016, 34:4354-4361.
产品研发中心 李国亮 文案
肿瘤事业部 李方方 编辑