温医大谷峰组报道新型CRISPR-Cpf1基因编辑系统
BioArt按: 作为新型的基因组编辑工具,CRISPR家族新成员-Cpf1近两年来受到广泛关注,并在动植物体模型和人类细胞的基因治疗领域中崭露头角。然而人们普遍认为来自16种不同细菌的Cpf1中仅有AsCpf1和LbCpf1能够高效地切割人类基因组。受限于此,由CRISPR-Cpf1衍生出来的哺乳类基因组编辑研究围绕AsCpf1和LbCpf1展开。北京时间9月8号凌晨,温州医科大学谷峰教授课题组在Nucleic Acids Research杂志上在线发表了题为“A new lease of life: FnCpf1 possesses DNA cleavage activity for genome editing in human cells”的研究论文,首次提出FnCpf1在人类细胞中存在颇为可观的切割效率,并系统测定了FnCpf1的相关参数,该结果更新了美国麻省理工大学张锋教授对Cpf1研究结论。
论文解读:
作为CRISPR II类系统中V型核酸酶,Cpf1展现出显著区别于CRISPR-Cas9的编辑特点:仅需要一个crRNA分子协助(无需tracrRNA组装, 并可在体内同时编辑多个基因【1】;PAM序列显示出类似于5'-TTN-3'或5'-TTTN-3’的选择性(而Spcas9的PAM序列为3'-NGG-5' )【2】;不同于Cas9在PAM位点附近产生平端裂解产物,Cpf1在种子序列的远端产生交错的双链断裂【3】;在人类细胞全基因组范围内,Cpf1具有较高特异性【4】。以上这些编辑特点使Cpf1被认为是一种非常有用的基因组编辑工具。自其问世,Cpf1在基因组编辑研发和应用上日新月异。2016年8月Nature Biotechnology同时在线刊载两篇利用AsCpf1和LbCpf1获得基因敲除小鼠的论文【5,6】;2017年3月Nature Plants刊登的一篇文章表明了AsCpf1和LbCpf1用于编辑植物基因组和调控植物转录的可行性【7】;2017年4月发表在Science Advance的最新论文,首次报道了利用AsCpf1和LbCpf1在人类细胞和疾病模型小鼠中实现高效的基因修复【8】。
谷峰教授带领的研究团队近两年来一直围绕新型基因组编辑工具Cpf1做了大量研究。他敏锐地注意到,目前国际上关于Cpf1的研究多以AsCpf1和LbCpf1为主体,然而,由于这两种Cpf1对PAM序列有较为苛刻的要求(5'-TTTN-3'),Cpf1的应用受到了极大的限制。为了解决这个问题,他带领团队试图寻找一种既能实现人类基因组编辑又具备较为简便的PAM序列的Cpf1家族蛋白。于是研究团队将目光锁定在FnCpf1——其识别的PAM序列更加灵活(5'-TTN-3')。
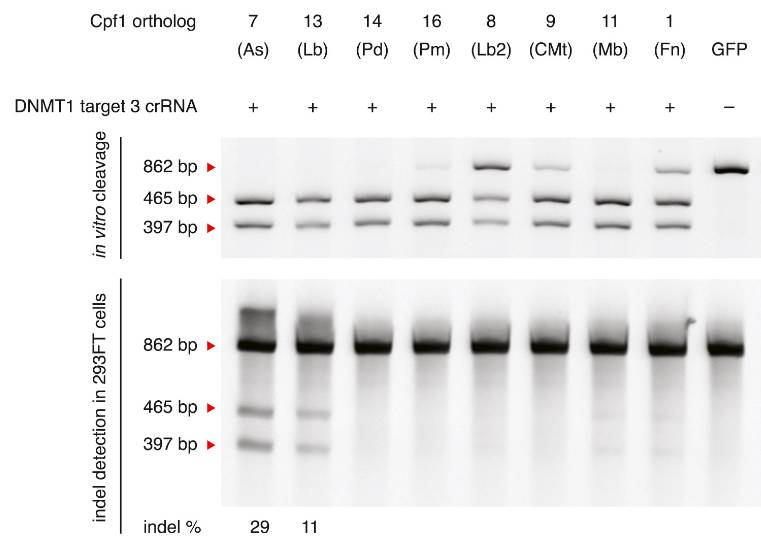
研究团队分别在荧光蛋白表达水平、DNA水平上检测到了FnCpf1对人类细胞内的外源性与内源性基因的编辑。研究发现FnCpf1确实能够极为有效地实现人类细胞的基因组编辑。值得注意的是,张锋教授课题组曾选取位于DNMT1和EMX1的两个靶位点测试了不同Cpf1家族蛋白对人类细胞内源性基因的编辑活性,实验结果表明FnCpf1在这两个位点仅能展现出极低活性和无活性【2】(下图)。谷峰教授带领的团队重复了来自该文献内的靶位点,实验结果与文献大体一致。于是研究人员在以上两个基因座及另外六个基因座内选取了多个靶位点,并通过T7E1、CAPS analysis、基因测序等多项技术都确定存在有效基因组编辑。“FnCpf1在人类细胞中无基因组编辑活性”这一观点得以“修改”。
图片引自:Zetsche, B. et al. Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System. Cell 163, 759 (2015).
目前,关于CRISPR/-Cpf1基因组编辑系统相关参数很不清晰, 相关参数仍有待进一步探索【9,10】,这些都是限制CRISPR/-Cpf1系统发展和应用的瓶颈所在。为了使FnCpf1能够更好地用于人类疾病的基因治疗,研究团队对其参数(包括间隔序列的长度、Direct repeat序列、PAM序列)进行了系统性的研究。由于利用经典的内源性基因作为靶分子很难获得大量定量数据,因此,在这项最新的研究中,科研人员利用携带绿色荧光蛋白的人类细胞系来全面定量地分析相关参数对CRISPR/Cpf1的影响【11】。此外,在PAM序列的探讨过程中,研究团队借鉴之前报道的LoxP-mT-LoxP-mG系统【12】,开发了另一新型PAM评价系统loxP-STOP-loxP / FnCpf1【13】。
经过进一步的探索,研究团队发现,能够实现FnCpf1最高编辑效率的间隔序列长度是21nt,而不是普遍使用的23-25nt;FnCpf1对不同Cpf1家族蛋白同源的Direct repeat序列具有一定程度的兼容性;其PAM序列的选择不仅局限于5'-TTN-3',研究成果将之扩展为5’-KYTV-3’(K指代T、G;Y指代C、T;V指代A、C、G)。此外,科研人员筛选了人类全基因组范围内潜在的脱靶位点并进行脱靶检测,结果显示FnCpf1在对人类全基因组编辑的过程中具有很高的保真性。
该研究修正并更新了张锋教授在CRISPR/Cpf1的结论,提出FnCpf1在人类细胞中存在颇为可观的编辑效率。对FnCpf1相关参数的系统性研究,为人类基因组编辑的基础研究和基因治疗的应用研究提供了新的工具。
据悉,该论文以温州医科大学14级硕士生涂孟俊为第一作者,温州医科大学谷峰教授为通讯作者,温州医科大学/附属眼视光医院为第一作者/通讯单位,该项目得到国家科技部973项目、国家自然科学基金等经费资助。
参考文献
1 Zetsche, B. et al. Multiplex gene editing by CRISPR-Cpf1 using a single crRNA array. Nature biotechnology 35, 31 (2017).
2 Zetsche, B. et al. Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System. Cell 163, 759 (2015).
3 Eszter, T. et al. Cpf1 nucleases demonstrate robust activity to induce DNA modification by exploiting homology directed repair pathways in mammalian cells. Biology Direct 11, 46 (2016).
4 Kleinstiver, B. P. et al. Genome-wide specificities of CRISPR-Cas Cpf1 nucleases in human cells. Nature biotechnology 34, 869-874 (2016).
5 Hur, J. K. et al. Targeted mutagenesis in mice by electroporation of Cpf1 ribonucleoproteins. Nature biotechnology 34, 807 (2016).
6 Kim, Y. et al. Generation of knockout mice by Cpf1-mediated gene targeting. Nature biotechnology 34, 808 (2016).
7 Tang, X. et al. A CRISPR-Cpf1 system for efficient genome editing and transcriptional repression in plants. Nat Plants 3, 17103 (2017).
8 Zhang, Y. et al. CRISPR-Cpf1 correction of muscular dystrophy mutations in human cardiomyocytes and mice. Science Advances 3 (2017).
9 Dong, D. et al. The crystal structure of Cpf1 in complex with CRISPR RNA. Nature 532, 522 (2016).
10 Fonfara, I., Richter, H., Bratovič, M., Rhun, A. L. & Charpentier, E. The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA. Nature 532, 517-521 (2016).
11 Zhang, Y. et al. Comparison of non-canonical PAMs for CRISPR/Cas9-mediated DNA cleavage in human cells. Sci Rep4, 5405 (2014).
12 Yang, F. et al. CRISPR/Cas9- loxP -Mediated Gene Editing as a Novel Site-Specific Genetic Manipulation Tool. Molecular Therapy Nucleic Acids 7, 378-386 (2017).
13 Tu, M. et al. A “new lease of life”: FnCpf1 possesses DNA cleavage activity for genome editing in human cells. Nucleic Acids Research (2017).
谷峰教授简介
谷峰,温州医科大学研究员/教授。2006年获得中国协和医科大学遗传学博士学位;2007年至2012年先后在美国康州大学健康中心、美国西雅图华盛顿大学医学院从事人类胚胎干细胞基因表达调控、基因打靶等相关研究;2012年7月入职温州医科大学并工作至今。