2017眼科疾病基因治疗进展一览
1、2017年2月20日,来自韩国基础科学研究所(IBS)基因工程中心的科学家与来自ToolGen Inc公司的KIM Eunji及首尔国立大学的KIM Jeong Hun合作开发出了迄今为止最小的Cas9,并使用腺病毒相关病毒(AAV)将之输送到小鼠肌肉细胞及眼睛中,以此修复损伤小鼠视力的基因,相关研究发表在Nature Communications上。这个CRISPR-Cas9系统来自空肠弯曲杆菌(CjCas9),很可能成为很有效的对抗常见无药可治疾病靶标的治疗性工具。
在这项研究中,研究人员证明输送到视网膜的CjCas9可以使HIF-1a与VEGF A(年性黄斑变性--AMD)失活,从而减少了脉络膜新生血管的面积
原文链接:In vivo genome editing with a small Cas9 orthologue derived fromCampylobacter jejuni. Nature Communications, 2017.
2、青光眼是世界范围内最常见的神经退变性疾病,约有7000万人受累。高眼压和年龄增长是青光眼的两个重要的危险因素。其特点是神经节细胞丢失。但是,导致神经节细胞随着年龄增长而易受损的机制尚不清楚。2017年2月22日《Science》上来自美国The Jackson Laboratory和Bascom Palmer Eye Institute的一项研究,对青光眼发病的机制进行探索,研究发现维生素B3和/或基因治疗(AAV载体提高年龄相关的NAD)可以显著抑制青光眼的发生。其机制是保护线粒体功能、降低眼压以及抗炎作用。通过对新的分子和代谢通路的研究,可能为青光眼及其他年龄相关性眼病的治疗提供新的思路。
参考文献:Williams PA, Harder JM, Foxworth NE, Cochran KE, Philip VM,Porciatti V, Smithies O, John SW. Vitamin B(3) modulates mitochondrialvulnerability and prevents glaucoma in aged mice. Science. 2017 Feb17;355(6326):756-760.
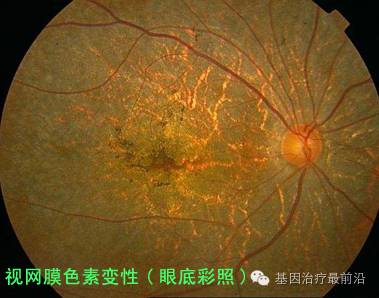
3、2017年3月14日,美国国立卫生研究院眼科研究所的一组研究人员报道了最新成果:他们通过一种病毒载体(AAV)直接向眼睛输送了基于CRISPR-Cas9的治疗元件,成功在视网膜色素变性小鼠中阻止了视网膜色素变性。这一研究成果公布在Nature Communications杂志上,文章的通讯作者是美国国立卫生研究院眼科研究所的吴志坚研究员(Zhijian Wu,音译)。
参考资料:Nrl knockdown by AAV-delivered CRISPR/Cas9 prevents retinal degeneration in mice
4、2017年3月18日,爱尔兰著名制药公司 Allergan 同美国基因编辑领域的领导者 Editas Medicine 宣布双方达成了一项战略性的研发合作联盟,Allergan 公司可以拥有 Editas Medicine 5 个基因编辑技术的眼疾病项目的排他性许可及选择权,这其中包括 Editas 临床前项目——用于雷伯氏先天性黑内障(LCA10)治疗的项目。
5、2017年3月20日,NightstaRx有限公司(“Nightstar”)是一家生物制药公司,专门开发用于遗传性视网膜营养不良的基因治疗,宣布开始招募和治疗受试者进行I / II期临床试验,以治疗X 性连锁视网膜色素变性XLRP。这是全球XLRP类型的第一次临床试验,并且从许可进展到临床试验仅仅用18个月的时间。
公司所使用的基因治疗方法采用最佳的一流创新,使用称为腺相关病毒(AAV)的病毒载体将色素性视网膜炎GTP酶调节剂(RPGR)基因的密码子优化拷贝输送到眼细胞中,首次用于临床测试。
该公司曾与牛津大学合作研发出了主要针对无脉络膜症患者的基因治疗药物—AAV2-REP1。该药物是由牛津大学Nuffield眼科实验室Robert MacLaren教授开发的治疗遗传性进行性失明疾病无脉络膜症的基因疗法。临床试验的治疗已经显示出可喜的成果。
6、2017年4月25日,来自加州大学圣地亚哥分校医学院与广州医科大学眼科专家朱洁研究团队的研究人员在《Cell research》发表视网膜色素变性疾病基因治疗结果,研究人员使用目前认定对人类不致病的A A V病毒作为载体携带CRISPR-Cas9,修复突变的杆状光学受体,使其功能恢复正常,这一技术成功地使两种不同类型的患有视网膜退行性疾病的小鼠的视力恢复了正常。
原始来源:Jie Zhu et al, Gene and mutation independent therapy via CRISPR-Cas9 mediated cellular reprogramming in rod photoreceptors, Cell Research (2017). DOI: 10.1038/cr.2017.57
7、2017年5月13日,Editas Medicine(马萨诸塞州剑桥一家领先的基因组编辑公司)今天宣布了临床前研究的成果,展示高效编辑非人灵长类动物视网膜中的CEP290基因--Leber先天性黑朦10型(LCA 10 )。
在这项研究中,研究者采用感光细胞特异性启动子启动表达引导RNA和Cas9,利用腺相关病毒(AAV)分别以两种不同剂量递送在单一的视网膜下,研究结果进一步加强了Editas关于其候选药物替代潜力的医学信念。
8、2017 5月16日 ,FDA批准ProQR(荷兰的一家生物技术公司)启动QR-110(反义寡核苷酸AON)治疗临床I / II期试验,QR-110正在被开发用于治疗Leber先天性黑朦10型(LCA 10 )。这种遗传性视网膜病变导致儿童严重视力丧失。 有关临床研究的更多信息,请访问ClinicalTrials.gov
9、2017 5月16日,国际期刊《柳叶刀》: 约翰霍普金斯大学的研究人员在一项基因疗法治疗湿性年龄相关性黄斑病变(AMD)的 I 期临床试验中获得令人振奋的结果:用病毒(AAV)将治疗基因引入眼睛的实验性基因治疗是安全的,并可有效改善湿性年龄相关性黄斑病变(AMD)患者的视力。
参考资料: Jeffrey S Heier,Saleema Kherani, Shilpa Desai, et al. Intravitreous injection of AAV2-sFLT01 in patients with advanced neovascular age-related macular degeneration: a phase 1, open-label trial. The Lancet, 2017. DOI
为什么基因治疗及干细胞治疗在眼科科研究取得很大突破?这和眼睛这一器官本身的特点有关:
首先,眼睛这一器官很小,因此干细胞治疗所用的细胞较少,那么制备干细胞过程中传代较少,导致传代过程中发生的变异就比较少,细胞较为安全。
其次,眼睛是全身唯一一个可以直视到后部结构如视网膜的器官,这样我们可以借助一些光学设备如手术显微镜、玻璃体手术器械在直视下操作,并精准定位到需要治疗的部位。
第三,眼睛是一个免疫豁免器官,细胞治疗在其他器官中容易受到免疫排斥,而在眼睛中就较易存活,而只有存活才可以发挥它的营养作用和再生作用,这也是细胞治疗的前景所在。
第四,眼睛这个器官在判定治疗效果时指标明确。相比较大的脏器功能指标的小的变化很难判定治疗效果。而眼睛在治疗后视力能提高2-3行就能明确并有力的证明治疗有效。此外,眼睛虽然是中枢神经组织的一部分,和其他神经组织有共性的地方,但是其末端细胞如光感受器细胞只有一侧和神经组织形成突触,这一特点使得其更容易实现再生治疗。
最后,眼睛有很多模型,较其他学科有更好的工具来进行研究,以上优势和特点造就了眼科近年来快速的进步。