基因编辑还能带来多少惊喜:CRISPR成功逆转亨廷顿病
基因编辑技术自问世以来,就被寄予了厚望。毫无疑问,这一技术有着强大的潜力,例如现今使用广泛的CRISPR / Cas9,激发了成千上万科研人员寻求新型治疗策略的想象力,对减轻疾病负担有着重要意义。科学家发现,这种改变基因的技术可以消除体外各种组织内的致病基因突变。日前,CRISPR技术正在开发用于直接治疗患者,相关临床试验已经在国内开始进行,并将很快在美国展开。但目前还没有任何临床试验使用这种技术来治疗神经退行性疾病。
日前,埃默里大学科学家领导的一组研究人员公布了最新研究成果,为神经退行性疾病的研究开辟了一条全新道路,并表示希望能够尽开展人体试验。研究小组表明,在作为亨廷顿舞蹈症疾病模型的9个月小鼠中,CRISPR / Cas9系统可以对小鼠脑中产生毒性蛋白质聚集体的部分基因进行剪切。此外,科学家们注意到,当他们观察应用载体的大脑区域时,几周后,聚集的毒性蛋白质几乎消失了。更令人惊讶的是,尽管没有达到对照小鼠的水平,但小鼠的运动能力的确有所改善。
这一研究结果于6月19日发表于Journal of Clinical Investigation期刊,题为“CRISPR/Cas9-mediated gene editing ameliorates neurotoxicity in mouse model of Huntington’s disease”。
图片来源:NIH
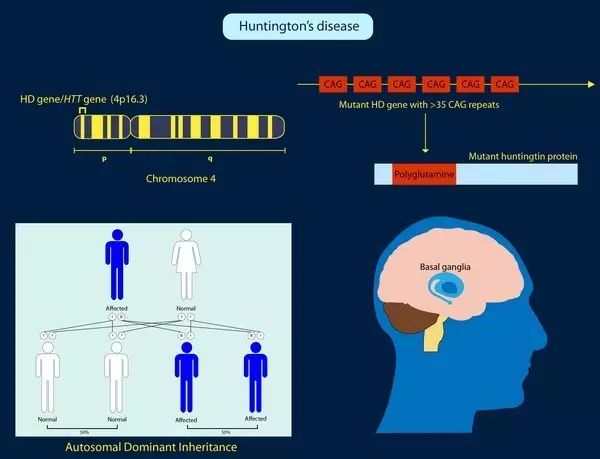
亨廷顿病主要由第四号染色体上的Huntington基因变异(mHTT基因)引起,进而产生毒性蛋白质(mHTT),最终导致神经细胞死亡。症状通常出现于中年时期,包括不受控制的运动、平衡问题、情绪波动和认知能力下降。在本研究中,科学家用使用人类mHTT基因取代了小鼠的一个亨廷顿氏基因。在这些小鼠中,运动问题和聚集的mHTT可以在9个月左右观察到。
作者表示,通过CRISPR / Cas9技术对内源性mHTT表达进行永久性抑制,能有效地减少HTT聚集,并减弱了早期神经病理学改变。此外,成年小鼠mHTT表达的减少并没有影响生存能力或活力,而是缓解了运动障碍。研究表明,非特异性CRISPR / Cas9介导的基因编辑可以被用来有效且永久地消除成年小鼠大脑中聚谷氨酰胺扩增导致的神经毒性。
图片来源:美国亨廷顿病协会
埃默里大学研究人员此前的研究表明,四个月以上的老鼠不需要亨廷顿蛋白基因保持健康,这意味着,旨在关闭成年人基因拷贝的治疗策略可能是安全的。
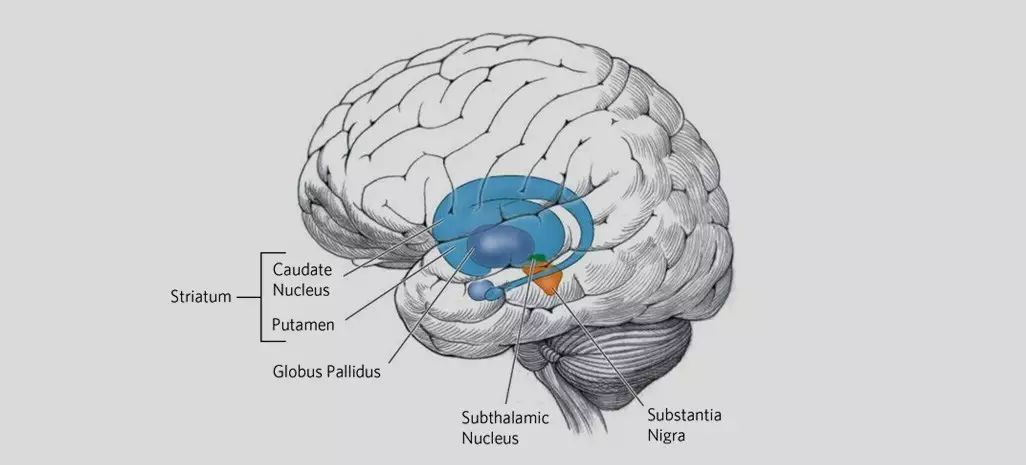
目前研究工作的主要挑战来自于将基因编辑系统定位到大脑的适当区域。为了实现这一点,研究团队利用了使用广泛的基于AAV(腺相关病毒)的基因治疗载体。科学家将携带CRISPR / Cas9的病毒载体注入9月龄的亨廷顿病模型小鼠脑中的纹状体区域。纹状体是控制身体运动和运动功能的大脑区域。
通过以上操作,研究人员发现在三周后,纹状体中聚集的mHTT水平急剧下降。研究还发现,如果去除了毒性蛋白的遗传来源,脑细胞会进行自我愈合。此外,与亨廷顿病小鼠相比,治疗后的小鼠在运动控制、平衡和握力等方面的测试中都显示出显著的改善,尽管它们没有恢复到对照组小鼠的水平。
为了衡量基因编辑的安全问题,研究人员观察到,在大脑细胞中,CRISPR / Cas9编辑的基因突变主要发生在亨廷顿蛋白基因内,而不是其他潜在的脱靶基因。
但作者也指出,在将这种方法应用于患者之前,还需要对基因编辑的长期影响和安全性进行严格的测试。
参考文献:
CRISPR/Cas9-mediated gene editing ameliorates neurotoxicity in mouse model of Huntington’s disease
· END ·