基因编辑是什么?它与转基因是不是一码事?
近来,基因编辑引发了巨大的关注,媒体上的相关文章越来越多。但很多人并不清楚它究竟是一种什么技术?还有它跟近两年社会上谈之色变的转基因技术是不是一码事?如果不是一回事,那区别又在哪?在这篇文章中,我们将对这种方法作一个高度概括。
基因编辑仿佛笼罩着神圣的光环。对很多医生来说,消除不良的DNA变异是他们的梦想。但除此以外,基因编辑还有很多不同的用途,比如引入我们想要的变异,建立动物疾病模型,培育具有优良性状的作物等等。
目前投入实用的各种基因工程方法不仅使用困难,而且效率低下,尤其是在编辑哺乳动物细胞方面。这导致科学家们想尽办法探索可以进行设计的基因编辑技术,其中最具发展前景的是CRISPR-Cas9系统。
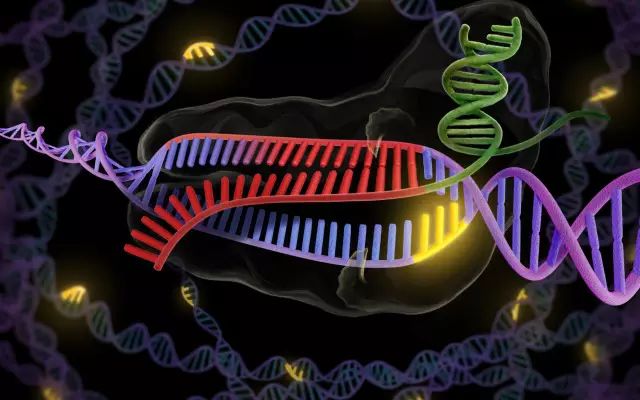
Cas9是一种内切酶,能剪切DNA双螺旋结构的两条链。有些内切酶会随机剪切DNA长度的任何位点。实际上,基因科学家们担心的一个问题正是核酸酶污染,它会污染DNA样本。其他内切酶会寻找特定的DNA序列,然后剪切那个位点。然而,同样的序列会在基因组中多次出现,因此无法用限制性内切酶来剪切特定的一个位点。
和限制性内切酶不同,细菌性Cas9能剪切特定的一个位点,被剪切的DNA序列是指定的。Cas9与CRISPR系统关联起来,后者使用一种小片段RNA来引导Cas9作用于靶位点。
在自然界,这种小片段RNA通常用来抵御病毒(噬菌体)序列。Cas9寻找病毒序列,然后剪切它,因此CRISPR系统是细菌抗病毒防御机制的一部分。
不过,这种引导Cas9的小片段RNA可以用研究人员选定的一个序列代替。CRISPR系统的一个好处在于,你可以提供不止一种引导分子,意味着你可以指导系统剪切不止一个位点。CRISPR系统能够确定它要剪切的DNA序列,但脱靶编辑仍然时有发生,科学家们一直在想办法解决这个问题。
激活CRISPR系统的机制有很多种,经过多年的研究,CRISPR-Cas9机制在探索可设计的基因编辑技术方面最具发展前景。到2013年,研究人员成功改造了两种细菌的CRISPR系统,可用于编辑哺乳动物细胞的基因。那两种细菌中包括一种制作酸奶的细菌。
上文讨论了如何让CRISPR系统剪切你希望它剪切的位点。然后呢?如果我们把基因编辑简单地理解成在DNA序列中删除错误的东西,或者插入想要的东西,那么把“正确的东西”或者“你想要的东西”插入基因组是如何做到的呢?
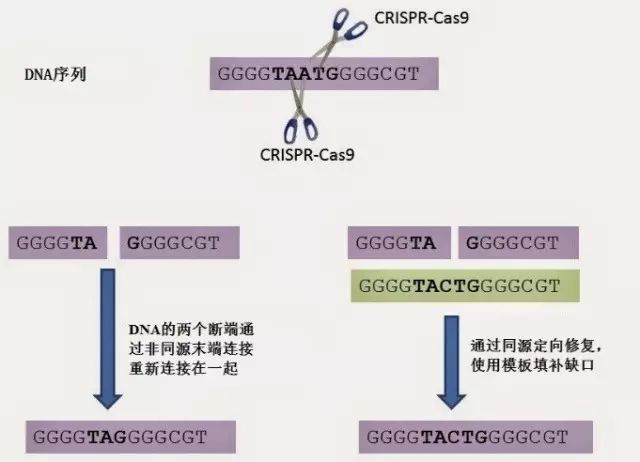
DNA被剪切后,细胞的修复机制启动,会发生以下两件事中的一件(如图):
DNA链的两个断端重新连接在一起。这个过程容易发生错误,但易于使用,如果你的目标是创造不起作用的蛋白或者彻底删除它,那么可以采取该途径。这个过程被称为非同源末端连接。
断裂被寻找合适模板用以便填补缺口的酶发现。如果那个模板是人工提供,那么其序列将被复制。研究人员提供的模板包含我们想要的序列、附加的序列等等。这个过程被称为同源定向修复。
CRISPR-Cas9基因编辑机制。CRISPR-Cas9系统在基因组中的指定位点剪切DNA。剪切端通过非同源末端连接或者同源定向修复实现修复。
也可以对CRISPR-Cas9系统进行修改,保留其“搜索”功能,但去掉剪切功能。这样一来,研究人员可以将他们选定的酶引导至特定区域。例如,可以给Cas9加上荧光标签,如此一来研究人员就可以用仪器观察到被研究的DNA序列位点。
看到这里,有人也许会提出某种脑洞大开的设想:可不可以写个电影剧本,内容是坏人把专门针对男主角基因组的Cas9混进他吃的食物中。
这会是天衣无缝的犯罪吗?CRISPR-Cas9会不会进入男主角的身体,破坏他的DNA?很可惜,这是做不到的。DNA是在我们的细胞核内,不太容易进入。而且,CRISPR-Cas9只存在于细菌中。让CRISPR-Cas9系统进入细胞核不是件易事,需要进行一些特殊的实验室研究。
到目前为止,市场上还没有使用基因编辑技术的医学疗法,也还没有使用CRISPR-Cas9进行修改的作物在市面销售。但研究表明,作物可以使用这种系统进行修改(已经有人提供了成功使用CRISPR-Cas9对大米进行基因编辑的例子)。因此,很多人想知道,通过基因编辑产生的作物会不会被视作转基因生物(GMO)。
目前我们所说的GMO,是指经过基因改造的生物,是将来自其他物种的基因添加到目标物种的基因组里去。但就使用CRISPR-Cas9进行修改的作物而言,被编辑的片段是本来就存在于基因序列内的。理论上说,在这个过程中并没有将不同物种的基因添加进去。那么,监管机构将如何归类这些作物呢?
早前在美国科研社交媒体ResearchGate上曾刊登过一篇名为《基因编辑技术监管的不明晰》(Regulatory uncertainty over genome editing)的报道,很好地总结了这方面的监管问题。作者休·琼斯(Huw Jones)写到,美国农业部认为,如果无法把基因编辑和自然发生的变异区分开来,那么这就不是GMO。
另外,如果基因使用细胞自身的修复机制进行删除(非同源末端连接就是如此),那么这也不是GMO。值得注意的是,该文写到,美国农业部已经对两种通过基因编辑产生的作物免予监管,因为它们属于上述类别。
琼斯写到,欧盟尚未决定这些作物如何归类,因为他们对转基因的定义为“不是通过交配和/或自然重组等自然发生方式出现的基因改变”(但通过诱变产生的作物在欧盟不受监管)。琼斯得出了两个重要结论:
如果欧盟和美国对GMO的定义不同,那么对这类作物的贸易监管将变得非常困难,因为缺乏一种简单的方法来界定作物是不是基因编辑的产物。
如果欧盟和美国对GMO的定义不同,那么让作物通过监管审查的高昂成本将使这些作物的培育仅限于大型生物科技公司,不利于创新。换句话说,如果你希望除了孟山都(Monsanto)、先正达(Syngenta)等巨头以外的中小企业培育生物科技作物,那么这些作物就不应该被视为GMO。
目前科技和科学界普遍认为CRISPR-Cas9系统拥有巨大的潜力和发展前景,是宝贵的作物基因改造工具,就像以前的转基因和诱变一样。但愿基因编辑最终实现小编长久以来的一个梦想:创造出可以用手剥皮的石榴!
翻译:于波
来源:Biofortified