基因治疗:基因类疾病治愈的希望
基因治疗临床意义重大,在部分适应症上,基因治疗比传统的治疗方案有明显优势,如单基因遗传病、肿瘤CAR-T疗法等。近年国外已有几款基因治疗产品上市,临床在研项目众多,部分也取得了非常好的效果,进入临床试验后期。综合来看,国外基因治疗行业已经逐步跨入成长期,有望于未来几年迎来大爆发。
一、治疗模式:“体外”、“体内”各有所长
目前基因治疗的模式主要有两种:“离体”治疗和“体内”治疗。
(一)“离体”治疗:技术难度偏小,可实现程度更高
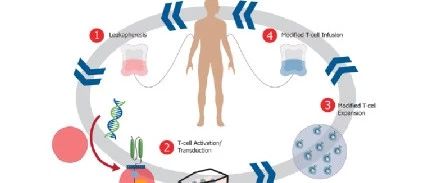
“离体”治疗的操作对象是从病人身上分离的细胞,根据细胞类型的不同可分为两大类:造血干细胞、T淋巴细胞等血液细胞和其他类型的细胞。(1)血液细胞:收集分离病人血液中特定类型的细胞后,利用基因改造的方式对细胞错误的基因进行修复或使其获得新的功能,再输回病人血液中,实现疾病的治疗。(2)其他类型的细胞:以遗传性大疱性表皮松解症为例,治疗时获取病人小块的皮肤,对皮肤细胞基因改造后,利用细胞自身的增殖能力,体外培养出较大的皮肤组织,再移植到病人身上,实现疾病的治疗。
与“体内”治疗相比,“离体”治疗的优势主要表现在技术难度较小、对载体的要求较低、安全性更高等几个方面。
技术难度较小:体外基因改造的技术方法已经较为成熟,临床上也产生了一些成功的案例。
对载体的要求较低:体外培养环境对病毒等载体的容忍度要远高于体内苛刻的环境,因此对于载体的靶向性、免疫原性等要求都大幅降低。
安全性更高:在体外对细胞基因修饰后,可作进一步的筛选,从中找到优质的细胞对病人进行治疗,降低安全风险。
然而,“离体”治疗也存在很大的局限性,主要表现为候选细胞种类有限、难以长期保持移植细胞功效等。
候选细胞种类有限:通过获取细胞、体外改造培养的方式,只能产生细胞类型单一的组织,细胞难以自发形成有功能、组成复杂、形态多样的组织和器官,因此较大程度上限制了“离体”治疗的应用范围。由于血液细胞通常是离散的单个细胞,不像其他组织器官那样是由多种类型的细胞按照特定的规律聚集组成,故而“离体”治疗方案更适用于血液细胞相关疾病的基因治疗。
难以长期保持移植细胞功效:部分细胞(如T细胞)的增殖能力有限且有一定的生存周期,改造的细胞回输病人体内后会逐步丧失增殖能力,逐渐死亡而消失,无法使病人获得长期的治疗效果。
综合“离体”治疗的优缺点,目前“离体”治疗主要还是集中于对T细胞和造血干细胞的改造上。此外,在部分特殊疾病的治疗上也取得了一些进展,如2015年德国波鸿大学医院的医生通过基因编辑的方法成功地对一名遗传性大疱性表皮松解症患者进行了治疗,并取得良好的效果。
(二)“体内”治疗:应用前景广阔,技术要求更高
“体内”治疗操作时只需要把携带目的基因的载体注入病变部位即可,理论上可以实现任意种类细胞的基因改造,不再像“离体”治疗那样受到细胞种类的限制,这是“体内”治疗相对“离体”治疗最大的优势,但在技术上真正实现任意细胞的基因改造目前还有一定难度。此外,“体内”治疗也省去了“离体”治疗的细胞收集、基因改造、培养扩增等繁琐的操作。
“体内”治疗的局限性主要在于载体要求高、安全风险大等,因此技术难度高于“离体”治疗。
载体要求高:携带目的基因的载体(如逆转录病毒)对于患者来说是外源性的,故而载体进入人体后会受免疫系统的排斥,使治疗效果打折扣;同时,目前大部分载体靶向性并不好,对组织和细胞类型没有选择性,要实现把目的基因递送到特定细胞中,现阶段常用的方法是体内定点注射载体,以期让载体在空间上尽可能地聚集在靶细胞附近。因此,选择合适的载体以缓解免疫排斥和靶向性等带来的问题是“体内”治疗最关键的要素之一。
安全风险大:相对于“离体”治疗,“体内”治疗在载体的细胞靶向性、基因靶向性等方面都还需要进一步改进,容易对正常细胞产生误操作,且无法通过筛选剔除误伤的细胞,故而比“离体”治疗风险更大。
“体内”治疗的靶组织和器官类型相对分散,目前主要在神经系统疾病、血友病、肌肉疾病、视网膜病变等疾病的治疗上取得了一些成效。
二、基因治疗的行业现状:转基因仍是主流,基因编辑潜力巨大
(一)多因素助力基因治疗取得成功
基因治疗的爆发始于20世纪90年代初期,现在再回头看当时那些基因治疗的成功案例,或多或少都带有一些运气的成分。经过近30年科学技术的发展,基因治疗越来越成熟,成功率也不断提高,主要得益于几个方面的因素:(1)病毒载体的改进提高了治疗的有效性和安全性,如目前应用最广的慢病毒载体和腺相关病毒载体;(2)载体制备和鉴定技术的发展使载体的纯度和效力都有了较大幅度的提升,既提高了细胞转染的成功率,同时也降低了不良反应的发生率;(3)基础的生物学知识储备不断增加,使得科学家对靶细胞、组织和器官的了解也愈发深入,能更准确地预见基因治疗能带来的效果和副作用,提前做好应对方案;(4)更细致的临床观察、更有效的分子监测也帮助科学家用更确切的证据去把握基因治疗的疗效和安全性;(5)受到1999年美国男孩死亡事件的影响,2000年以后科学家对基因治疗临床试验的开展更加谨慎,对临床试验方案的设计也做了改进,比如招募只表现出早期症状的患者参加试验,而不是进展至疾病晚期的患者,这也在一定程度上提高了临床试验的成功率。
(二)技术和人才是行业最大的壁垒
尽管目前基因治疗在部分领域取得了一些进展,但仍有不少亟待解决的问题。基因治疗技术上的难点主要是如何提高有效性以及降低安全风险。和许多新兴技术一样,能够解决行业痛点的关键技术和人才是基因治疗行业目前最大的壁垒。
对于基于转基因技术的基因治疗来说,现阶段遇到的技术瓶颈主要是(1)病毒载体多缺乏靶向性,并不能特异性地感染病变细胞,即使不同亚型的腺相关病毒对某些组织具有部分选择性,但也远达不到特异识别的程度,因此进行“体内”治疗时,目前只能通过局部定点注射的方式,限制了临床应用范围;(2)目前临床上广泛使用的逆转录病毒和慢病毒在感染宿主细胞后会把自身的基因组插入宿主细胞的基因组中,其插入的位置是随机的,存在引起插入突变及细胞恶性转化的潜在危险;腺相关病毒虽然属于非整合型病毒,但仍存在插入宿主基因组的可能性;(3)理想的基因治疗应能根据病变的性质和严重程度不同,调控治疗基因以适当的水平或方式表达,但现有的基因导入系统载体容量有限,不能包容全基因或完整的调控顺序,从而只能借用病毒自带的基因表达调控元件,导致目的基因的表达量无法调控,也不能达到正常生理状态下的表达水平;(4)病毒载体具有一定的毒性和免疫原性,注入患者体内后容易被人体的免疫系统所清除,同时也带来副作用;(5)病毒载体的基因导入效率仍有进一步提升的空间。对于基于基因编辑技术的基因治疗来说,关键的技术难点主要是(1)基因编辑技术,特别是CRISPR技术面世的时间还太短,存在太多不确定的因素,再加上科学家对人类基因功能和调控网络的认知还非常不足,轻易改动基因可能引发无法预见的安全问题;(2)基因编辑系统导入细胞的效率和基因编辑的效率都还不高,尚无法真正实现临床上的大规模应用;(3)基因编辑系统与病毒载体一样也不具有细胞靶向性。
无论转基因技术还是基因编辑技术,要解决当前临床应用面临的技术难题,对载体和系统进行优化升级都是最直接、最有效也是无法回避的方式。此外,基因治疗多为个体化的治疗方案,真正实现商业化还需要做出较大的优化和改进。除了技术上的瓶颈,基因治疗还存在专利壁垒和伦理纠纷等非技术障碍。
(四)基因治疗的临床应用:重点布局肿瘤和遗传病
1、CAR-T:“离体”基因治疗目前最成功的应用
CAR-T治疗(Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫治疗)是“离体”基因治疗目前在临床上最成功的应用。CAR-T技术现阶段主要用于血液肿瘤的治疗,主要代表是FDA于2017年批准的Kymriah(诺华)和Yescarta(Kite)两款产品;实体肿瘤的治疗尚属于探索阶段,还需要等待技术上出现革命性的突破。病人接受CAR-T治疗时,科学家先从病人的外周血中分离得到T细胞,再利用慢病毒等载体将人工改造的目的基因导入T细胞,使T细胞转变成CAR-T细胞,从而获得了特异性识别并杀伤肿瘤细胞的能力;待CAR-T细胞扩大培养至一定数量后,再回输给病人,实现肿瘤的治疗。
以白血病为例,传统的化疗和放疗在临床上已经使用了几十年,对大部分的白血病有效,疗效和副作用都相对明确,故而现阶段仍是临床上首选的治疗方案,但化疗和放疗对一部分病人的治疗效果并不理想。因此,CAR-T的意义在于给这些传统疗法无效的患者提供新的治疗方案,并且多个CAR-T产品均已在临床上取得了非常好的治疗效果。然而,白血病只是CAR-T临床应用的起点,且目前CAR-T尚作为三线治疗方案,未来随着技术的不断改进和成熟,CAR-T技术有望在除白血病之外的其他血液肿瘤乃至实体肿瘤的治疗上取得突破,这将彻底改变目前肿瘤治疗的格局,拥有很大的成长空间。
2、地中海贫血:基因治疗有望颠覆现有治疗方案
地中海贫血即珠蛋白生成障碍性贫血,患者通常表现出常见的贫血状态以及相应的并发症,其致病机制是珠蛋白基因缺陷使血红蛋白中的珠蛋白肽链有一种或几种合成减少或不能合成,导致血红蛋白的组成成分改变,进而引发红细胞寿命缩短,表现为慢性溶血性贫血。地中海贫血属于常染色体隐性基因遗传病,当夫妻双方均为致病基因的携带者时,其后代有25%的概率会患病,50%的概率为致病基因携带者,25%的概率基因完全正常。
针对地中海贫血,目前临床上常规的治疗方案是定期输血,患者需要终身治疗,治疗费用昂贵,且容易产生输血副反应;根治方案是进行造血干细胞移植,将健康人的造血干细胞植入病人体内,可实现疾病的治愈,但最大的障碍是造血干细胞配型非常困难,即使配型成功,多数病人接受治疗后仍需长期服用免疫抑制性药物。最有前景的治疗方案是基因治疗,从病人的外周血中收集造血干细胞后,利用病毒载体将正常的珠蛋白基因导入其中,使细胞功能恢复正常,再将改造后的造血干细胞回输给病人。造血干细胞来源于病人自身,因此不存在配型和排斥的问题。改造的造血干细胞进入病人体内后,会源源不断地产生功能正常的新的红细胞,从而达到缓解甚至治愈疾病的目的。综合比较,目前临床上地中海贫血的治疗方案都存在诸多缺陷,而基因治疗则在很大程度上填补了这个临床未满足需求,待技术进一步成熟后,有望在临床上迅速得到推广,进而取代目前并不完美的治疗方案。
3、镰刀型细胞贫血:基因编辑或将抹除自然选择的“印迹”
镰刀型细胞贫血是一种常染色体隐性基因遗传病,主要见于非洲黑人,也见于中东、希腊、土籍印第安人及与上述民族长期通婚的人群。正常的红细胞呈圆饼状,而患者的红细胞呈镰刀状,其携带氧的功能只有正常红细胞的一半。患者出生半年后症状逐渐出现,除了表现出贫血的相关症状外,临床上患者还常伴有生长发育迟缓、骨骼发育异常等表现。
镰刀型细胞贫血的病理在于β-珠蛋白基因发生单碱基突变,改变了β-珠蛋白的氨基酸序列,导致血红蛋白溶解度下降,进而形成管状凝胶结构,引起红细胞扭曲成镰刀状。由于形态异常,镰刀型红细胞易在细微血管分支处聚集,造成血管阻塞,严重者甚至死亡。
目前镰刀型细胞贫血尚无法治愈,临床上采用的治疗方案多只能缓解症状,如输血、造血干细胞移植等,而基因治疗有望对镰刀型细胞贫血进行根治。不同于地中海贫血转基因的治疗方案,镰刀型细胞贫血需要对患者自身错误的基因进行纠正,故而在采集病人的造血干细胞后,可利用基因编辑技术,把突变的基因变回正常的基因,使造血干细胞的功能得到恢复,再将改造后的造血干细胞回输给病人,实现疾病的治疗。
4、艾滋病:从偶然医疗事件到基因治疗
艾滋病又称获得性免疫缺陷综合征,由人免疫缺陷病毒(HIV)感染引起。HIV进入人体后,主要攻击CD4阳性的T淋巴细胞,破坏人体的免疫系统,最终患者多因免疫系统崩溃而罹患肿瘤或受其他病原体感染致死。研究发现,HIV感染T细胞需要由细胞表面的多种蛋白共同介导,因此阻断这些蛋白与HIV的识别有望治愈艾滋病。
科学家曾偶然发现一名艾滋病患者在接受骨髓移植后其体内的HIV消失了,这意味着这名患者的艾滋病被骨髓移植治愈了。进一步研究发现,其骨髓捐献者天然携带CCR5△32这种基因变异,而该基因原型CCR5是介导HIV感染T细胞的关键蛋白之一,这种基因突变阻断了HIV感染T细胞的途径,使T细胞获得了抵抗HIV的特殊能力。因此,通过基因编辑的方式,将患者造血干细胞的CCR5基因替换成CCR5△32,即可使患者新生成的T细胞获得抵抗HIV的能力,再辅以抗病毒药物的治疗,有望实现艾滋病的治愈。该技术成熟以后,将彻底终结目前“谈艾色变”的局面。
5、血友病:基因治疗让“外伤出血”不再可怕
常见的血友病(A型和B型血友病)是X染色体连锁的隐性基因遗传病。患者因凝血因子基因缺陷导致凝血功能障碍,临床表现为终身轻微外伤即发生长时间出血。凝血因子有很多种,每种凝血因子均在凝血的过程中发挥重要作用,不同凝血因子基因的缺陷会产生不同类型的血友病,临床均表现为凝血障碍。
目前临床上血友病的治疗方案主要是替代治疗,即给患者注射其血液中缺少的凝血因子。这种治疗方案的缺陷很明显,不能治愈、需要终身治疗,治疗费用非常昂贵。基因治疗的思路非常明确——缺啥补啥,只需要利用转基因的方式给患者自身的细胞补充其缺失的凝血因子基因即可。凝血因子主要由肝细胞产生,因此血友病基因治疗的操作对象是患者的肝细胞。不同于地中海贫血和镰刀型细胞贫血的治疗,“离体”基因治疗方案在血友病中行不通,只能采取体内治疗的方式。通过原位注射将携带正常基因的病毒载体注入肝组织中,病毒载体再把正常基因导入肝细胞,实现基因的补偿,治愈血友病。
6、溶瘤病毒:从“恶魔”到“天使”的华丽变身
溶瘤病毒是基因治疗在肿瘤治疗上的另一个应用。通过基因改造,科学家赋予了传统病毒全新的功能:(1)溶瘤病毒感染肿瘤细胞后能大量增殖并使肿瘤细胞发生裂解,但在正常细胞中溶瘤病毒的增殖受到限制,降低了副作用;(2)改造后的溶瘤病毒携带某些能抑制肿瘤细胞分裂的基因,当病毒感染肿瘤细胞后会抑制肿瘤细胞增殖,从而实现肿瘤的控制;(3)某些改造后的溶瘤病毒具有肿瘤细胞靶向性,进一步提高了肿瘤杀伤效果,降低了副作用。溶瘤病毒是目前众多肿瘤治疗方案的一部分,技术成熟后有望单独使用或和其他治疗方案联合使用,提高肿瘤的可治愈性。
国内医药企业也紧跟国际技术发展前沿,目前有几百家公司开展与基因治疗相关的业务,主要集中在东部沿海一带。虽然基因治疗在国内如火如荼地开展,但与国外还有不小的差距,我们认为这个现象是中国医药生物的科研和技术水平长期落后于国外导致的,不仅仅只是基因治疗这一个领域。从全球范围来看,基因治疗在经历了10多年的行业大整改之后刚刚进入快速发展的阶段,国内外的差距要小于其他传统医药领域,国内企业仍拥有后来居上的潜力。
版权声明
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。







