基因突变及临床意义汇总查询
AML基因表达/突变异常临床对照表
|
基因名称 |
异常情况 |
发生率 |
临床意义 |
|
FLT3 |
ITD和TKD突变 |
20-30% |
预后不良 |
|
NPM1 |
突变 |
20-25% |
独立突变预后良好 |
|
MLL |
PTD突变 |
5-7% |
预后不良 |
|
KIT |
突变 |
6% |
预后不良 |
|
CEBPA |
突变 |
8-10% |
独立双突变预后良好 |
|
DNMT3A |
突变 |
10-20% |
预后不良 |
|
IDH1/IDH2 |
突变 |
10% |
独立突变预后良好,可能对去甲基化药物反应好 |
|
TET2 |
突变 |
5-10% |
预后不良,可能对去甲基化药物反应好 |
|
EZH2 |
突变 |
5% |
预后不良 |
|
AML1 |
突变 |
3-5% |
预后不良 |
|
ASXL1 |
突变 |
3-5% |
预后不良 |
|
PHF6 |
突变 |
2-3% |
预后不良 |
|
TP53 |
突变 |
2-3% |
预后不良 |
ALL基因表达/突变异常临床对照表
|
基因名称 |
异常情况 |
发生率 |
临床意义 |
|
JAK1/JAK2 |
突变 |
5-10 % |
高危Ph样ALL(5-10%),DS-ALL(18-35%),预后不良 |
|
PAX5 |
突变/缺失 |
6-8% |
B-ALL,预后意义无统一结论 |
|
TP53 |
突变 |
8-10% |
B-ALL,预后不良 |
|
IKZF1 |
缺失/突变 |
15% |
B-ALL,预后不良 BCR-ABL1的ALL发生率80% |
|
CRLF2 |
过表达 |
5-15% |
B-ALL,预后不良 |
|
PHF6 |
突变/缺失 |
3-5% |
T-ALL,预后不良 |
|
NOTCH1 |
突变 |
10% |
T-ALL,预后意义无统一结论 |
|
FBXW7 |
突变 |
8% |
T-ALL,如无BCR-ABL1,预后较好 |
|
PTEN |
突变/缺失 |
3-5% |
T-ALL,预后不良 |
MDS基因表达/突变异常临床对照表
|
基因名称 |
异常情况 |
发生率 |
临床意义 |
|
TP53 |
突变 |
6% |
预后不良 |
|
TET2 |
突变 |
2-20% |
预后不良,去甲基化药物可能有效 |
|
DNMT3A |
突变 |
5-10% |
预后不良 |
|
SF3B1 |
突变 |
20% |
主要在RARS中突变 |
|
EZH2 |
突变 |
6% |
预后不良,去甲基化药物可能有效 |
|
RUNX1 |
突变 |
10% |
预后不良 |
|
ASXL1 |
突变 |
10-15% |
预后不良 |
|
IDH1/2 |
突变 |
5-10% |
预后不良,去甲基化药物可能有效 |
|
U2AF1 |
突变 |
1-5% |
预后不良 |
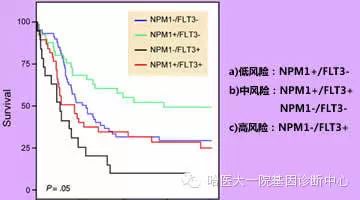
NPM1/FLT3-ITD突变检测意义
NPM1基因突变在AML患者中检出率近30%,而在正常核型AML患者中检出率可达46-62%,成为正常核型AML患者最常见的基因突变。NPM1基因突变主要类型为其第12外显子上4bp的插入,与AML治疗及预后关系密切,见于50%以上具有正常核型的AML患者。发生NPM1基因突变的患者,其生存期和无病生存期较长,且对细胞抑制剂治疗敏感。
FLT3-ITD可见于>25%的AML患者,在核型正常AML患者中发生率更高。FLT3为原癌基因,其突变会增加患癌风险,AML患者中常见突变类型为ITD。其中FLT3-ITD突变状态可作为监测微小残留疾病(MRD)的标记,检测呈阳性的患者可以考虑用FLT3激酶抑制剂来治疗。
联合NPM1及FLT3_ITD的突变状态,能够帮助预测患者的风险程度及优化治疗策略,例如:NPM1+FLT3-ITD-的患者预后最好。
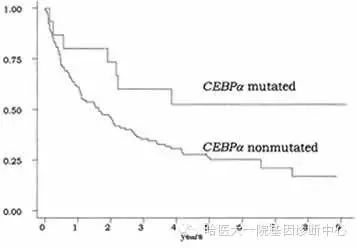
CEBPA基因TAD1/2,bZIP突变检测意义
CEBPA基因编码的转录因子主要在髓单核细胞中表达,在粒细胞生成中起到重要作用;可与CDK2和CDK4激酶互作,抑制细胞生长。在正常核型的AML患者中,有13~15%的患者存在CEBPA基因突变,其主要类型为TAD1、TAD2及bZIP区域的插入/缺失突变。
研究显示CEBPA突变是一项相对良好的预后指征。如下图所示,CEBPA基因突变的患者其整体生存时间(OS)显著长于野生型患者。因此,检测AML患者CEBPA基因的突变状态在预后诊断中具有重要的指导作用。在AML的病人,与CEBPA没有突变的病人相比,CEBPA突变的病人总生存期较长,然而,CEBPA突变患者往往同时存在FLT3-ITD突变,FLT3-ITD突变能够降低患者的总生存期,因此单纯CEBPA突变的AML患者预后较好,若同时伴随FLT3-ITD突变,将会影响AML患者对化疗药物诱导的缓解效果,预后仍然不佳。
C-KIT基因突变检测意义
C-KIT突变主要发生在第17外显子和第8外显子上的点突变,第17外显子突变位点包括D816Y, D816V, Y823N,有时还会出现D816E 和 D820H。可以激发酪氨酸残基磷酸化,从而调节细胞的生长,对肿瘤的增殖,恶性演进以及凋亡等方面有重要作用。
第17外显子的突变会导致较高的复发风险,是正常患者复发风险的六倍。此外,第17外显子和第8外显子的突变对AML患者的OS有负面影响。可以用酪氨酸激酶抑制剂药物来抑制突变。还可以利用点突变检测进行癌症早期预测,转移性肿瘤的流动和微小残留病变的研究。在inv(16)染色体易位的病人,评估C-KIT突变的病人,发现:与C-KIT没有突变的病人相比,易复发,但位于C-KIT外显子8的单位点突变则不易复发。
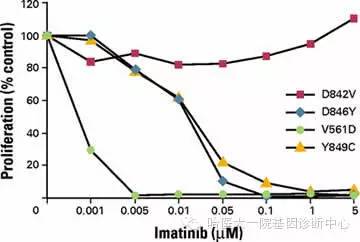
PDGFRA基因D842突变检测意义
PDGFRA基因编码的血小板衍生物生长因子受体α是一种细胞表面酪氨酸激酶受体,在细胞增殖、分化、生长、发育及包括癌症的多种疾病中起到重要的调节作用。
8~10%的胃肠间质瘤患者带有PDGFRA基因突变,且此突变与c-Kit基因突变互斥。其主要突变类型为第18外显子的点突变D842,在临床治疗中,伊马替尼和舒尼替尼对带有PDGFRAD842V突变的患者无效。相比于PDGFRA基因其他位点突变的患者,在用Imatinib治疗后,其细胞增殖不能被有效抑制。
DNMT3A基因突变检测意义
DNMT3A突变主要见于急性髓性白血病(AML),骨髓增生异常综合症(myelodysplasticsyndromes)以及骨髓及骨髓增生性肿瘤(myeloproliferative neoplasms)患者。在慢性粒细胞白血病(CML)患者中,约有10%患者体内检测出DNMT3A突变。DNMT3A突变多是杂合的,属于显性失活突变,体外实验时,可以降低甲基转移酶的活性50%以上。该突变最普遍发生在氨基酸位点R882处,突变率为11.5%,在该位点附近的突变有着功能获得性的活性。
目前一项涉及500名初发性急性髓性白血病(de novo AML)患者的研究中,约有14%的患者体内出现DNMT3A突变,在这些带有DNMT3A突变的患者中,有22.9%的患者都具有正常核型。DNMT3A突变与年龄,较高的白细胞计数,较高的血小板计数,中度风险,正常的细胞遗传,以及FLT3-ITD,NPM1,PTPN11,IDH2这些基因突变是呈正相关的,但与CEBPA基因的突变是呈负相关的。
DNMT3A突变可以影响治疗方法和治疗结果,可以作为有正常核型的完全缓解患者和无复发患者的独立的预后因子。发生DNMT3A突变的患者相对于那些没有发生突变的患者有着更高的复发率。DNMT3A突变还可作为初发性急性髓性白血病患者的治疗和生物学特征,可以作为检测微小残留病变的生物标记。
|
CR |
Relepse rate |
OS |
RFS |
|
|
突变 |
74.4% |
65.6% |
14.5 M |
7.5 M |
|
无突变 |
79% |
48.8% |
38 M |
15 M |
WT1基因表达定量
WT1基因最早发现于Wilms瘤,编码一个锌指转录因子。大约75 %的AML患者的白血病细胞有WT1 的高水平表达,且WT1基因高表达的患者缓解率低、预后差。WT1基因可作为一种泛白血病标志用于缺乏遗传学标志的AML患者微量残留病(MRD)检测的指标。在AML患者缓解后的随访过程中,如果实时定量PCR显示WT1基因的表达水平增高,往往提示疾病可能复发。AML患者首次诱导后WT1表达水平下降>2 log是预后良好的标志。