基因编辑技术CRISPR/Cas9助攻内源性Promoter驱动CAR 治疗肿瘤
基因编辑技术CRISPR/Cas9助攻内源性Promoter驱动CAR 治疗肿瘤
陈光风
(独立生物医学科技评论人)
有时候评论文章的题目真的很难取,直接翻译怕有些非专业的朋友们看不懂,题目取大了又成为了标题党,取得朴实一些又读起来不流畅,关键是还有些英文单词在里面搞得莫名其妙。
且听我把题目解释一下,梳理一下。“基因编辑技术CRISPR/Cas9助攻内源性Promoter驱动CAR 治疗肿瘤”实际上可以分为三段“基因编辑技术CRISPR/Cas9”,“助攻内源性Promoter驱动CAR”以及“治疗肿瘤”。这样就好懂多了。
那么什么又是基因编辑(gene edition)技术呢?简单来讲,就是可以对细胞中的基因进行修改、改造,比如删除一些DNA序列或者插入一些DNA序列的技术。基因编辑技术多次入选《科学》、《自然》等国际权威杂志的“十大科技突破”,是生物医学领域最热门的前沿技术之一。其发展到现在,已经经历了多次大的技术更迭与突破,主要包括三大类基因编辑技术,其一是基于锌指核酸酶(zinc finger nuclease, ZFN)的基因编辑技术;其二是基于转录激活样效应因子核酸酶(transcription activator-like effector nuclease, TALEN)的基因编辑技术;其三是现目前使用最为广泛的基于CRISPR(Clustered regularly interspaced shortpalindromic repeats)系统的基因编辑技术。我们这里提到的CRISPR/Cas9就属于第三种,也是目前使用最广泛的基因编辑技术。
关于基因编辑技术的研究已经积累了太多知识和应用,足够写一本厚厚的书了,在此按下不表。
“Promoter”是“启动子”的意思,其为一段DNA序列,简单而言,就是基因的转录(transcription)从这个地方开始,从这个地方启动,就是说,要是没有启动子,基因就不能够启动转录,就像汽车没有发动机就不能够启动一样。
“CAR”是什么意思呢?以为是一辆车吗?非也!
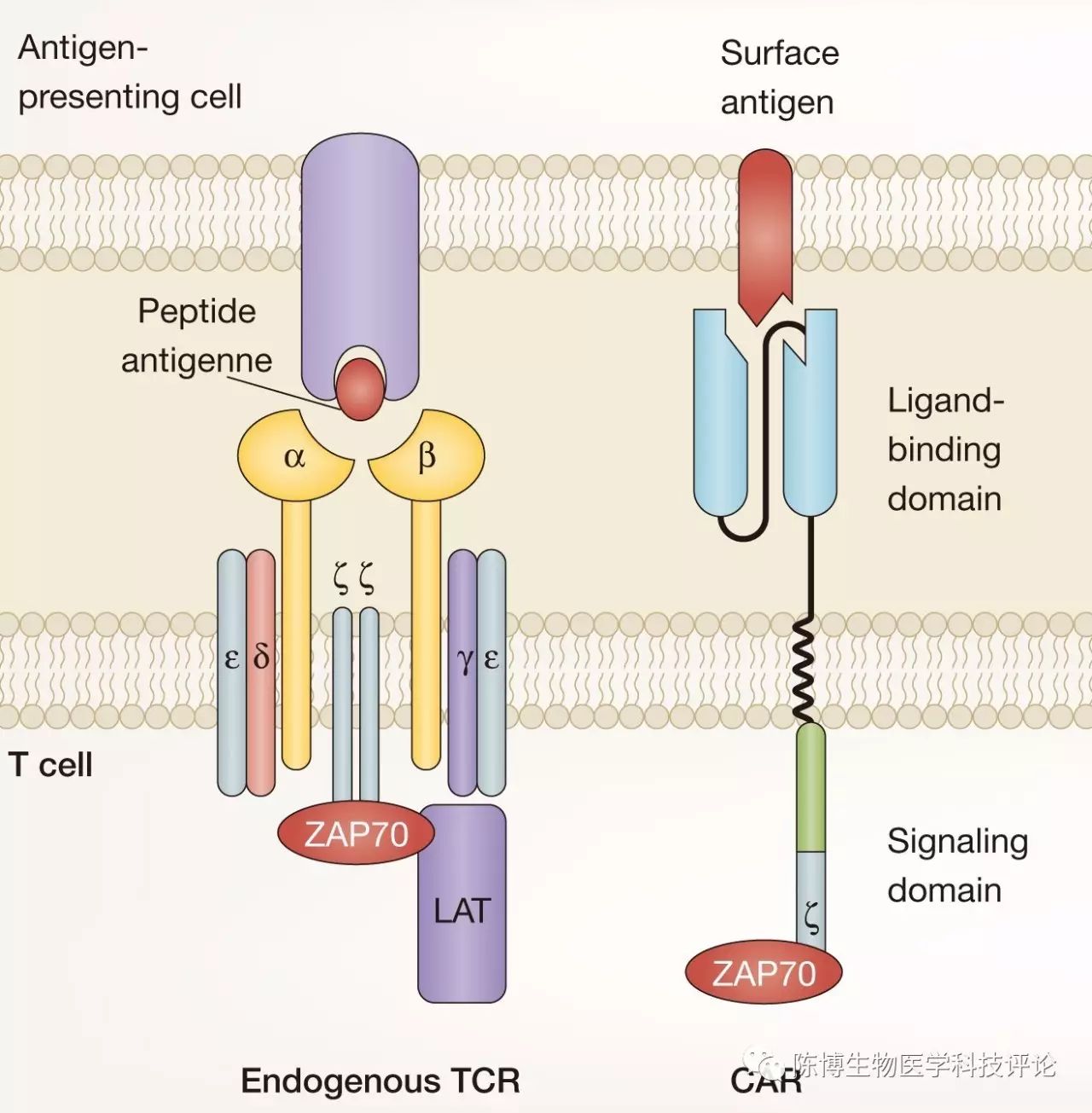
“CAR”是“Chimeric Antigen Receptor”的首字母缩写,中文名称是嵌合抗原受体。那么,嵌合抗原受体又是什么呢?详细说来就太复杂了,简单而言,就是一个经过基因工程改造的能够特异地识别肿瘤细胞的蛋白。它的结构如下图一所示【1】,左边这个就是天然存在的T细胞受体TCR(T Cell Receptor, TCR),其在人体内存在于T细胞的表面,能够识别经过抗原递呈细胞(antigen-presenting cell, APC)呈递到表面的抗原(antigen);而右边这一组显示的就是CAR的结构了,其主要包括细胞膜外的结合抗原的区域、跨细胞膜的区域以及细胞内的信号传递相关区域,是经过基因工程改造后的非天然蛋白,其主要的特点就在于能够特异性地识别肿瘤细胞表面的相应的抗原。
图一
(引自Fesnak AD等,Naturereviews Cancer 2016)
带有CAR蛋白的T细胞就称为CAR-T细胞(chimeric antigen receptor T cell, CAR-T),是目前最热门的细胞免疫治疗肿瘤的前沿技术之一【2】。其主要特点就是结合了T细胞杀伤肿瘤细胞的优势和CAR特异性结合肿瘤细胞的特性来消灭肿瘤细胞,目前已经在肿瘤治疗方面取得了瞩目的成就。
CAR-T技术的研究和应用已经取得了长足的发展,积累了非常多的研究,在此且按下不表。
此处单说最近Memorial Sloan Kettering癌症研究中心的科学家在《自然》杂志上面报道了一种利用内源性启动子启动T细胞表达CAR来杀伤肿瘤的方法【3】。这一研究报道对CAR-T技术及其应用领域具有重要的价值。
为何?要评价这个研究有没有新意,有没有价值,且看看在此之前的其他研究就能够明了。
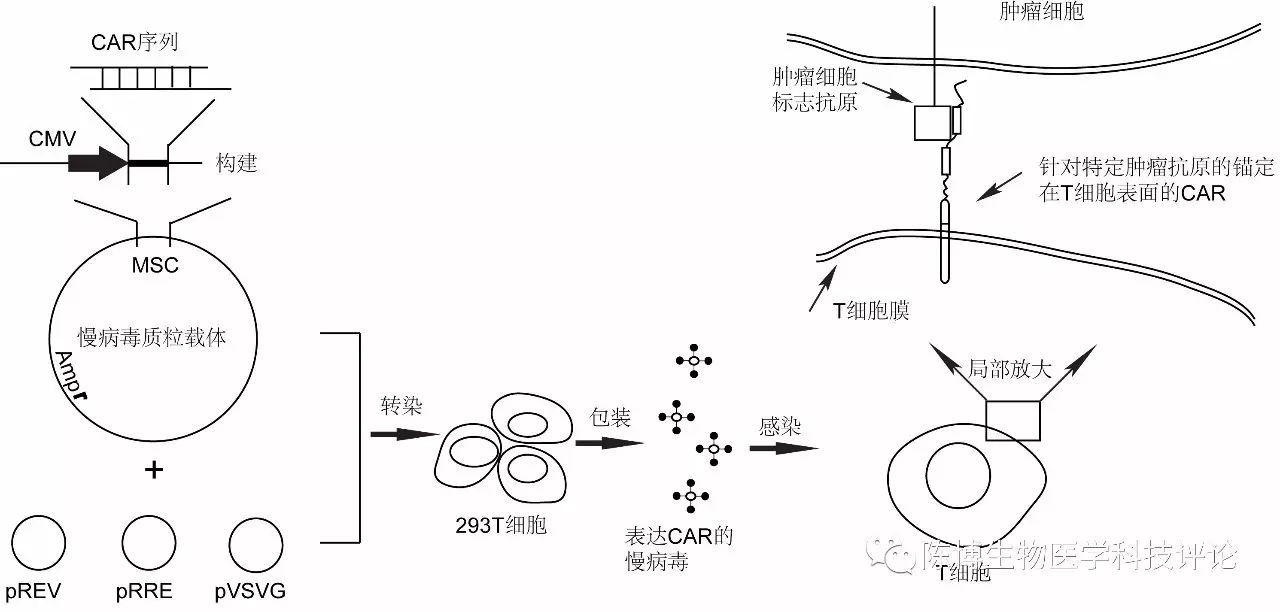
在此之前,科学家们是如何让CAR蛋白存在于T细胞表面的呢?以慢病毒(lentivirus)介导的CAR为例,如下图二所示(自己画的黑白图,朋友们就将就了吧)。首先,通过DNA合成(DNA synthesis)技术合成能够在细胞中表达CAR蛋白的DNA序列;然后通过分子克隆技术(molecular cloning)将CAR的DNA序列装进一种称为质粒载体(plasmid vector)的更长的环状DNA中。
图二
pREV、pRRE以及pVSVG为辅助质粒(helper plasmid)
质粒载体有什么作用呢?大多数质粒的作用就是把装在多克隆位点的基因或DNA序列在细胞中表达(expression)成蛋白质。这里举例的这种质粒载体DNA是经过人工改造的,包含其他的DNA组件比如表达抗生素的基因序列、启动子序列、多克隆位点(multiple cloning site, MCS)等等,并且,其可以和其他一些经过基因工程改造的辅助质粒(helper plasmid)一起在工程细胞(比如293T细胞)中自动组装成有感染(infection)能力的慢病毒。这样的慢病毒就具有在细胞中表达CAR蛋白的作用。
因此,将这样的慢病毒加入培养T细胞的培养基中,其就能够感染T细胞,即进入T细胞,然后利用T细胞内的元素来表达CAR蛋白,这些CAR蛋白表达之后就锚定在T细胞的表面(上面的图二)。
目前科学家们基本上都是采用病毒介导的基因表达技术,比如慢病毒(lentivirus)、逆转录病毒(retrovirus)、腺病毒(adenovirus)、腺相关病毒(adeno-associated virus,AAV)等,相关研究内容浩如烟海,在此不题。
然而,不得不说的是,这些病毒技术都有一定的不足。主要就在于慢病毒和逆转录病毒进入进入细胞之后,就会随机地插入(insertion)到基因组中,而腺病毒和腺相关病毒也会有一定的概率插入到基因组中,这可能会破坏细胞中的基因,从而导致细胞异常,甚至可能会让细胞转变成肿瘤细胞,进而引发肿瘤【4】。因此,采用这些病毒技术来制备CART进行细胞免疫治疗会有引发肿瘤的风险。
那么,有没有方法可以解决解决这一棘手的安全性问题呢?
其实,在此之前已经有科学家团队对此问题报道了一些解决方法,比如利用基因编辑技术将目的DNA片段插入不会引发肿瘤的基因组位点,比如CCR5基因位点或者AAVS1基因位点【5】。
本篇重点介绍的研究就是采用这种方法来解决病毒介导方法的随机插入引发的肿瘤风险问题,而且还做到了“一石二鸟”。
何也?盖不但能够解决DNA片随机插入基因组的风险问题,还能够同时制备一种所谓“通用型CART”。
且听慢慢道来。
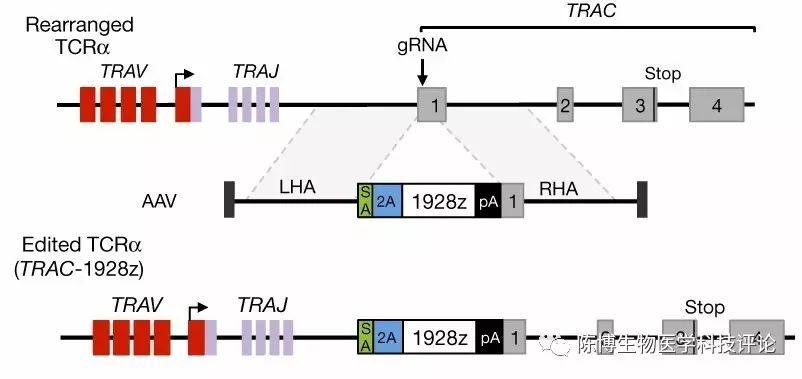
如下面的图三所示,研究者利用CRISPR/Cas9基因编辑技术,将一段包含CAR表达序列的DNA序列(即图中的名称为1928Z的一段序列)定点插入T细胞的TRAC基因的外显子1(Exon1)中。大家注意到,插入的序列中有几小段SA、2A以及pA表示什么意思呢?先说这个2A,其实它在这里的意思是可以表达一种可"自我剪切"的短小肽的序列,这段核酸序列约有60几个核苷酸长,表达的短小肽称为P2A(peptide 2A),P2A在细胞中可以被识别它的蛋白酶切割成两段,因此,在分子克隆中经常被科学家们用来隔断两个融合在一起表达的蛋白,最终达到表达的两个蛋白互不干扰的结果。
图三
(引自Eyquem J等,Nature2017)
而这个SA和pA又表示什么呢?实际上,这两个组件是一种非常成熟的基因操作方法的组成原件,叫做基因陷阱或者基因捕获,英文名为gene trap。那么什么是基因陷阱呢?从字面意思可以简单理解为为基因做的一个陷阱。什么意思呢?在细胞中,表达的基因序列一般包含内含子和外显子,而转录成的成熟mRNA,一般只转录外显子而不转录内含子,那么转录的蛋白复合物是如何识别外显子和内含子的呢?原来外显子含有一段SA序列,叫做剪接受体(splice acceptor, SA)。而pA是poly A的简写,就是有许多A碱基,这样转录到这里就停止转录了。Gene trap的研究资料非常多,在此不再科普。
话说,这些序列合在一起,整合到T细胞的TRAC基因的Exon1前面,但是在“promoter”后面,这样转录复合物识别“promoter”后,就会被人工构建的包括SA-2A-1928Z-pA序列所“诱骗”,以为这段序列是TRAC基因的外显子序列,因此就会毫不犹豫进行转录,这样就达到了表达1928Z这段CAR序列的目的。
前面不是说“一石二鸟”吗?现在说完了“诱骗”T细胞内的TRAC基因启动子驱动表达CAR解决随机插入基因组这一问题的这一“鸟”,另外“一鸟”在哪里呢?
且听我道来。
前面讲到,“诱骗”T细胞内的TRAC基因表达开始于“SA”,然而这只是开始,那么“诱骗”什么时候结束呢?前面也稍微提了一下,那就是“pA”。简单地说来,因为正常情况下,转录复合物遇到pA序列时就会相当于得到“停止转录”的命令,故这种“诱骗”从SA到pA这段序列就结束了,至于后面的TRAC基因的外显子1,2,3及4,转录复合物都视而不见,因此,T细胞内真正的TRAC基因实际上并未表达。
T细胞内真正的TRAC基因实际上并未表达有什么重要的意义呢?这就和我们前面提到的“通用型”CART有关了。是的,目前绝大多数CART都是“自身”的,意思就是说,我的T细胞改造成的CART只能我自己用,别人不能够用。为何?因为这会存在严重的免疫排斥。
因此,科学家们就在想能不能制造一种“通用型”的CART(当然,前提是只针对一个特定的抗原而言的,比如CART-CD19)呢?这样,大家都可以用,也便于大规模生产,控制产品质量等等好处。
这是可以的。早在2012年,Hiroki Torikai等就报道了利用基因编辑技术破坏T细胞的TRAC基因、TRBC1基因及TRBC2基因,从而让T细胞不表达T细胞受体TCR,而T细胞表面的TCR正是引起免疫排斥的主要分子,从而构造出所谓的“通用型”CART【6】。值得注意的是,如前面的图一所示,TCR主要由α和β两个亚基组成,而TRAC基因表达α亚基核恒定区域,TRBC1基因及TRBC2基因均表达β亚基恒定区域。
而Memorial Sloan Kettering癌症研究中心的科学家在《自然》杂志上面报道的文章也是采用的这一思路,即让T细胞内的TCR不表达就行,就可以制造这种“通用型”CART了。
故,他们的研究“一石二鸟”总结起来就是,制造一种内源启动子驱动的通用型CART。当然,他们的在研究中还探讨了一些其他的问题,比如TRAC基因的启动子比其他启动子好,又比如这种内源性启动的CART细胞存货时间长、发挥效率高,能够更加有效地控制小鼠肿瘤的生长等等。
可以总结起来说,想法是不错的,虽然也不是完全创新,但是这个方法也算是目前制造CART的一种具有一定的优势的方法了,至少在研究上具有优势。在进一步临床应用上面还不好说,因为单就这种CART的制备就比一般的CART制备方法复杂一些。同时,研究论文中的试验数据还表明,这种方法生产出来的CART仍然还有20%-30%的T细胞表面存在TCR,因此,也算不上完全是“通用型”的CART。简之,还有较长的路要走。
参考文献:
1. Fesnak AD, June CH, Levine BL: Engineered T cells: the promise and challenges of cancer immunotherapy. Nature reviews Cancer 2016, 16(9):566-581.
2. Barrett DM, Singh N, Porter DL, Grupp SA, June CH: Chimeric antigen receptor therapy for cancer. Annual review of medicine 2014, 65:333-347.
3. Eyquem J, Mansilla-Soto J, Giavridis T, van der Stegen SJ, Hamieh M, Cunanan KM, Odak A, Gonen M, Sadelain M: Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 2017, 543(7643):113-117.
4. Yu J, Hu K, Smuga-Otto K, Tian S, Stewart R, Slukvin, II, Thomson JA: Human induced pluripotent stem cells free of vector and transgene sequences. Science 2009, 324(5928):797-801.
5. Wang J, DeClercq JJ, Hayward SB, Li PW, Shivak DA, Gregory PD, Lee G, Holmes MC: Highly efficient homology-driven genome editing in human T cells by combining zinc-finger nuclease mRNA and AAV6 donor delivery. Nucleic acids research 2016, 44(3):e30.
6. Torikai H, Reik A, Liu PQ, Zhou Y, Zhang L, Maiti S, Huls H, Miller JC, Kebriaei P, Rabinovich B et al: A foundation for universal T-cell based immunotherapy: T cells engineered to express a CD19-specific chimeric-antigen-receptor and eliminate expression of endogenous TCR. Blood 2012, 119(24):5697-5705.