一周精读:水稻中一个转录因子天然等位基因赋予稻瘟病广谱抗性
A Natural Allele of a Transcription Factor in Rice Confers Broad-Spectrum Blast Resistance
Weitao Li, Ziwei Zhu, Mawsheng Chern, Junjie Yin, Chao Yang, Li Ran, Mengping Cheng, Min He, Kang Wang, Jing Wang, Xiaogang Zhou, Xiaobo Zhu, Zhixiong Chen, Jichun Wang, Wen Zhao, Bingtian Ma, Peng Qin, Weilan Chen, Yuping Wang, Jiali Liu, Wenming Wang, Xianjun Wu, Ping Li, Jirui Wang, Lihuang Zhu, Shigui Li, and Xuewei Chen (陈学伟)
State Key Laboratory of Hybrid Rice, Key Laboratory of Major Crop Diseases and Collaborative Innovation Center for Hybrid Rice in Yangtze River Basin, Rice Research Institute, Sichuan Agricultural University at Wenjiang, Chengdu, Sichuan 611130, China (四川农业大学水稻研究所)
Highlights
-
A single base change (SNP33-G) in the bsr-d1 promoter enhances binding to MYBS1
-
Binding of MYBS1 to the bsr-d1 promoter suppresses bsr-d1 expression
-
BSR-D1 promotes peroxidase expression, suppressing immunity to M. oryzae
-
The SNP33-G allele is present in 10% of 3,000 surveyed rice varieties
Summary
Rice feeds half the world’s population, and rice blast (稻瘟病) is often a destructive disease (毁灭性病害) that results in significant crop loss. Non-race-specific resistance (非小种专化抗性,又叫水平抗性) has been more effective in controlling crop diseases than race-specific resistance (小种专化抗性,又叫垂直抗性) because of its broad spectrum (广谱) and durability (耐久性). Through a genome-wide association study, we report the identification of a natural allele of a C2H2-type transcription factor in rice that confers non-race-specific resistance to blast. A survey of 3,000 sequenced rice genomes reveals that this allele exists in 10% of rice, suggesting that this favorable trait (优势性状) has been selected through breeding. This allele causes a single nucleotide change in the promoter of the bsr-d1 gene, which results in reduced expression of the gene through the binding of the repressive MYB transcription factor and, consequently, an inhibition of H2O2 degradation and enhanced disease resistance. Our discovery highlights this novel allele as a strategy for breeding durable resistance in rice.
水稻作为重要粮食作物,为全球过半人口提供食物,而水稻稻瘟病是能够大幅度降低水稻产量的毁灭性病害。非小种专化抗性因其具有广谱抗性和耐久性,因而较小种专化抗性在控制水稻病害方面更为高效。本文作者通过全基因组关联分析鉴定了水稻中控制稻瘟病非小种专化抗性的C2H2类转录因子上的一个天然等位基因。通过对3000份水稻的重测序分析发现该等位基因在10%的水稻中存在,表明这个优势性状已在水稻育种中受到了选择。该等位基因在bsr-d1基因的启动子区造成了一个核苷酸的改变,从而通过结合抑制转录因子MYB降低该基因的表达,进而抑制了H2O2的降解,最终增强了水稻的疾病抗性。作者在本文中新发现的等位基因为水稻培育持久性的抗性品种提供了新的育种策略。
Introduction
植物相较于动物而言,除了缺少细胞内的免疫系统,一样都具有其天然免疫系统。植物中的天然免疫可分为两个层次,一是病原相关分子模式触发性免疫(PTI),二是效应因子触发性免疫(ETI)。PTI响应主要包括MAP激酶激活、活性氧ROS诱导、胼胝质沉积和病原相关(PR)基因诱导。ROS的爆发通过交联糖蛋白加强细胞壁和激活防御信号元件来对病原侵袭作出早期响应。
病原会通过向植物细胞中递送效应物抑制宿主的PTI响应来为自己创造一个合适的生存环境。植物又对应地进化出由包含核苷酸结合区和富含亮氨酸重复序列(NBS-LRR)的抗性R基因编码的细胞内感应器来感应病原效应物,从而引发ETI。ETI会赋予植株包括对过敏反应在内的非常强力的抗性,然而这种抗性只针对于少数几种病原且由于病原效应物进化迅速而不具耐久性。因为聚合R基因来提高作物的抗性非常耗时,所以发掘具有广谱抗性且耐久的基因颇为受育种者们的青睐。
目前为止,植物中只发现分离了6个基因具有广谱抗性,分别是拟南芥的RPW8.2基因,水稻中的STV11基因,小麦中的Lr34和Yr36基因,这几个是显性等位基因,还有就是水稻中的pi21基因和大麦中的mlo基因,这两个是隐性等位基因。在这6个基因中,仅有3个基因的分子机制被阐明。拟南芥中的RPW8.2基因,定位于吸器外膜,会激活依赖于水杨酸(SA)的防御反应,从而对白粉病具广谱抗性。水稻中的STV11基因,编码磺基转移酶,催化SA转变为磺化SA ,从而对水稻条纹病毒具持久抗性。小麦中的Yr36基因,编码kinase-START蛋白,会磷酸化叶绿体中类囊体相关的抗坏血酸过氧化物酶,从而对条锈病具广谱抗性。虽然这些基因已经应用到品种改良中,然而由于这些基因会和某些不良的农艺性状连锁遗传,因此限制了它们的应用。比如,小麦中Lr34系比没有Lr34系的籽粒产量低;大麦中的mlo突变体会引起叶片过早黄化早衰。因此,新的具广谱抗性且不会和不良农艺性状连锁的基因有待发现。
由水稻稻瘟病菌引发的水稻稻瘟病是能够大幅度降低水稻产量与品质的毁灭性病害。除了最近报道的关于水稻-稻瘟病菌病害系统上的最新进展,大部分的研究主要集中于R基因介导的稻瘟病菌拮抗与互作。除了Pid2和Pid21两个基因,所有的稻瘟病抗性基因都编码NBS-LRR蛋白。Pid2基因编码一个β-凝集素类受体激酶。Pi21基因编码一个含金属结合结构域且富含脯氨酸的蛋白,其功能缺失突变体(pi21)赋予植株持久的广谱抗性。Pi21基因的特性以及其不影响产量和籽粒品质的事实使得该基因成为一个比较好的遗传改良候选基因。然而,比较遗憾的是,Pi21基因应用因与造成劣质籽粒的LOC_Os04g32890基因连锁而受到限制。
Digu是对于稻瘟病具有持久的、广谱抗性的一个水稻品种,为发现具有广谱抗性的新基因提供了极好的资源。本文,作者报道了一个新的等位基因(bsr-d1),该等位基因参与了Digu品种对于稻瘟病持久、广谱的抗性。Bsr-d1编码了一个 C2H2类转录因子,其被MYB家族的转录因子直接调控。这两个转录因子调节H2O2降解酶的表达,以此来帮助植株获取稻瘟病抗性,构成了稻瘟病抗性新机制。
Results
-
全基因关联分析锁定Digu稻瘟病抗性相关等位基因bsr-d1
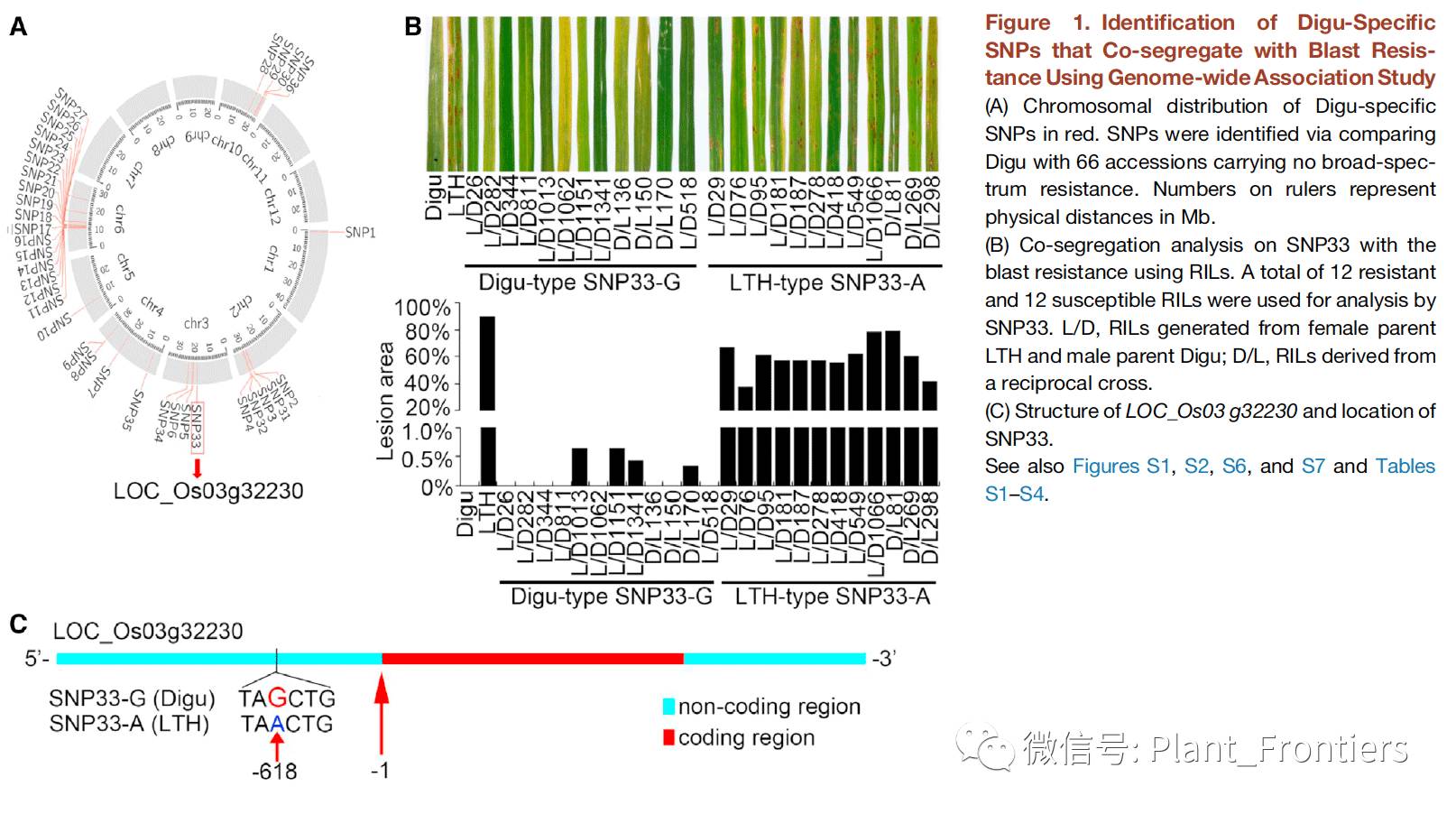
作者通过全基因关联分析比较了Digu品种和来自中国国家作物基因库(CNCGB)中534个已测序水稻随机抽取的66个不具稻瘟病广谱抗性的水稻品种来研究Digu中影响稻瘟病广谱抗性的关键基因。作者共鉴定Digu中2,576特异SNPs,这些SNPs中,30非同义SNPs位于25个基因的外显子中,6个SNPs位于6个基因上游1.5 kb启动子区的顺式作用元件中(Figure 1A)。作者开发了衍生酶切扩增多态性序列(dCAPS)方法去研究这31个鉴定基因上的SNPs。为了进一步研究这些SNPs,作者通过将Digu和高易感性品种LTH进行杂交获得3,685个重组自交系(RILs:通过杂交产生的F2代个体连续多代自交产生的自交系)群体。通过选择74个在表型上与亲本LTH完全不同且缺失之前已从Digu中分离出的Pid2, Pid3和两个R基因的RILs,这74个RILs中有42个对稻瘟病接易感,32个对稻瘟病接种具抗性。作者在这两种品种中分别选择了10个分析了SNPs的分布情况,初步发现SNP33与稻瘟病抗性相关联。进一步地扩大到所有的42和32个RILs中发现SNP33与稻瘟病抗性完全共分离(Figure 1B)。这些结果表明Digu中等位基因LOC_Os03g32230上的SNP33(SNP33-G)与广谱稻瘟病抗性紧密关联。SNP33-G位于LOC_Os03g32230基因的启动子区(Figure 1C)。因此作者将其命名为broad-spectrum resistance Digu 1(bsr-d1)。基于PCR测序的结果显示Digu和LTH中在LOC_Os03g32230基因编码区无差异,但在其启动子区存在21个单核苷酸改变和2处缺失。
-
稻瘟病菌诱导易感水稻栽培种中Bsr-d1的表达(在抗性品种中不会)
为了研究bsr-d1在水稻稻瘟病免疫中发挥的作用,作者测定了不同水稻株系和栽培种中感染稻瘟病前后bsr-d1的表达量。有趣的是,在不接种稻瘟病菌时,LTH中的Bsr-d1 RNA水平是Digu中的两倍;而在接种稻瘟病菌后,LTH中的Bsr-d1 RNA水平提升了4倍左右,而Digu中则保持不变,这使得接种稻瘟病菌后LTH中的Bsr-d1 RNA水平是Digu中的八倍左右。作者还测试了Digu类的RILs和LTH类的RILs中的Bsr-d1 RNA水平,发现Digu类RILs中的Bsr-d1 RNA水平与Digu一致,保持在较低的水平,不受稻瘟病菌的诱导;而LTH类RILs中的Bsr-d1 RNA水平与LTH一致,受到稻瘟病菌的诱导,但存在一定的波动。这些结果说明Bsr-d1基因与稻瘟病易感性状相关,其在LTH会受到稻瘟病接种的诱导,而在Digu中则不会。
为了进一步研究Bsr-d1基因表达为何会被稻瘟病接种诱导,以及其对水稻易感稻瘟病的机理,作者进一步测定了其它3个携带Digu等位基因的水稻栽培种和5个携带LTH等位基因的水稻栽培种中的Bsr-d1基因表达水平。作者发现,在所有携带LTH等位基因的水稻栽培种中Bsr-d1基因的表达会被稻瘟病接种诱导,而所有携带Digu等位基因的水稻栽培种中Bsr-d1基因的表达会被抑制。所有的3个携带Digu等位基因的水稻栽培种测定为对稻瘟病具抗性,而5个携带LTH等位基因的水稻栽培种测定为对稻瘟病易感。这些结果表明,稻瘟病菌诱导Bsr-d1基因的表达是作为一种抑制宿主免疫的策略;而在Digu品种中可能进化出了一种应对策略,抑制受稻瘟病菌对Bsr-d1基因表达的诱导。
-
沉默、过表达和CRISPR介导的Bsr-d1敲除验证了其在Digu抗性中的作用
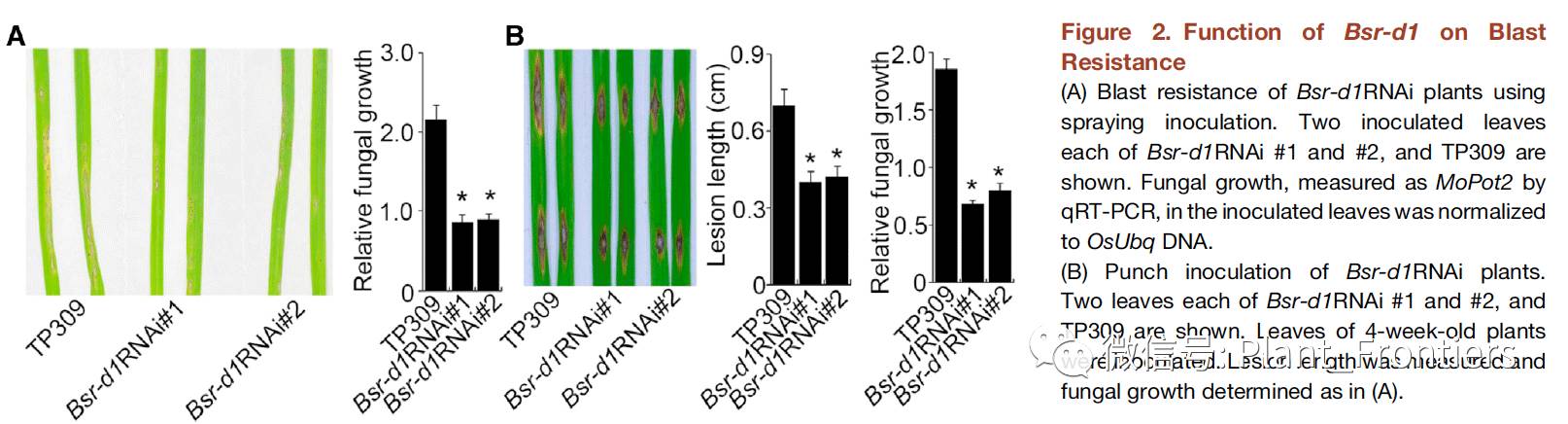
作者通过RNA干扰和过表达的方法获取了转基因水稻植株,用以进一步评估Bsr-d1基因在Digu稻瘟病抗性中的作用。作者在水稻栽培种TP309中获取了8个可能的Bsr-d1RNAi株系并测定了这些株系中的Bsr-d1 RNA水平。Bsr-d1RNAi 株系#1 和#2中相较于野生型TP309的Bsr-d1 RNA水平降低了35%。作者进一步通过测量与 Bsr-d1核苷酸序列高度相似的LOC_Os03 g32220基因的表达量来排除交叉沉默的影响,结果显示LOC_Os03 g32220基因的表达量并未出现下降。作者通过对野生型TP309、Bsr-d1RNAi 株系#1和#2的植株喷散分生孢子接种稻瘟病,结果发现除了野生型TP309上出现了典型的稻瘟病病变,在Bsr-d1RNAi 株系#1和#2中仅发现了小的、零星的病变(Figure 2A),表明Bsr-d1基因的沉默会增强对稻瘟病的抗性。作者又通过在控制的环境条件下在离体叶片上打孔的方法重复接种试验,结果显示Bsr-d1RNAi 株系#1和#2中相较于野生型TP309病变范围更小(Figure 2B),病变的长度减少了30%到35%。真菌DNA定量分析结果表明Bsr-d1RNAi 株系中的稻瘟病菌DNA含量仅为野生型的30%(Figure 2B)。这个转基因植株的稻瘟病抗性与转基因在后代植株中共分离。
作者还构建了两个Bsr-d1基因过表达(Bsr-d1ox)株系,其植株中的Bsr-d1基因表达升高通过验证。通过接种Bsr-d1ox #1和#2株系稻瘟病,发现易感性较野生型有所提高(Figure 2C)。这两个过表达的株系中稻瘟病病变约是野生型的两倍(Figure 2C)。真菌DNA定量分析结果表明Bsr-d1ox株系中的稻瘟病菌DNA较野生型要多(Figure 2C)。因此,RNAi和过表达试验的结果均表明Bsr-d1基因作为水稻稻瘟病抗性的负调节因子。
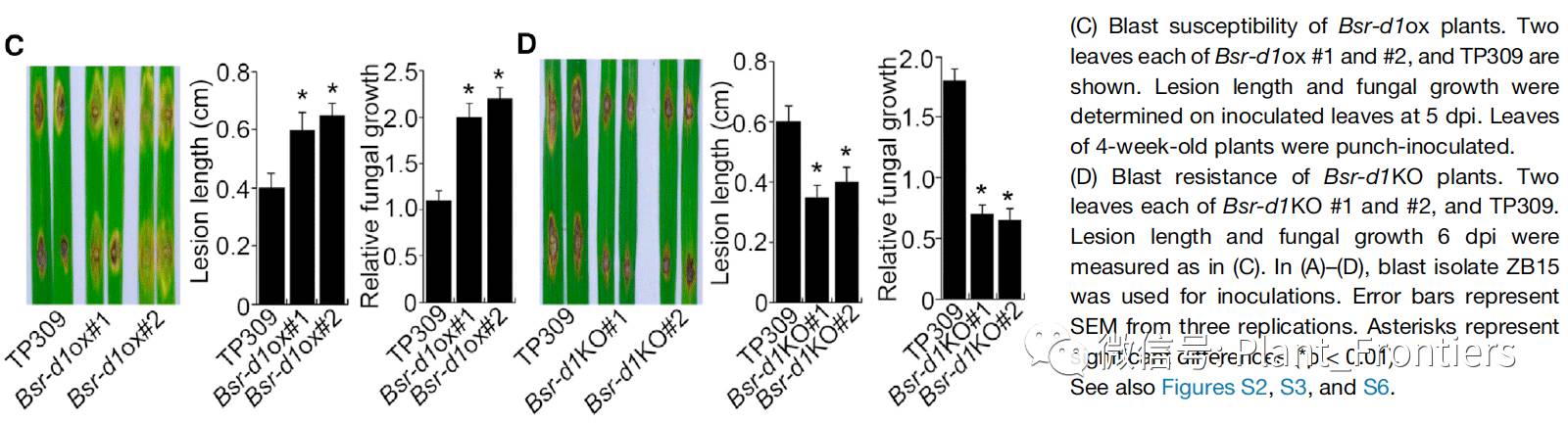
另外,作者借助于CRISPR技术敲除野生型TP309中的内源Bsr-d1基因,获取Bsr-d1基因功能缺失植株(Bsr-d1KO)。作者在Bsr-d1基因选取了两个20-nt的序列作为Cas9切割的靶位点,产生了多个假定的转基因株系,通过PCR扩增靶位点确认是否敲除成功。结果,作者获得了4个靶位点1的突变系(Bsrd1KO #1)和3个靶位点2的突变系(Bsrd1KO #2),Bsrd1KO #1和#2各自在其靶位点携带了一个碱基的插入,导致了Bsr-d1基因开放阅读框的截断。作者通过打孔接种的方法向Bsrd1KO #1和#2中接种稻瘟病ZB15分离菌。结果显示,相较于野生型TP309,这两个Bsrd1KO株系的病变更小,病变长度约是减少了50%,真菌DNA含量也仅为野生型的30%(Figure 2D)。
-
Bsr-d1基因敲除株系与Digu一样拥有稻瘟病广谱抗性
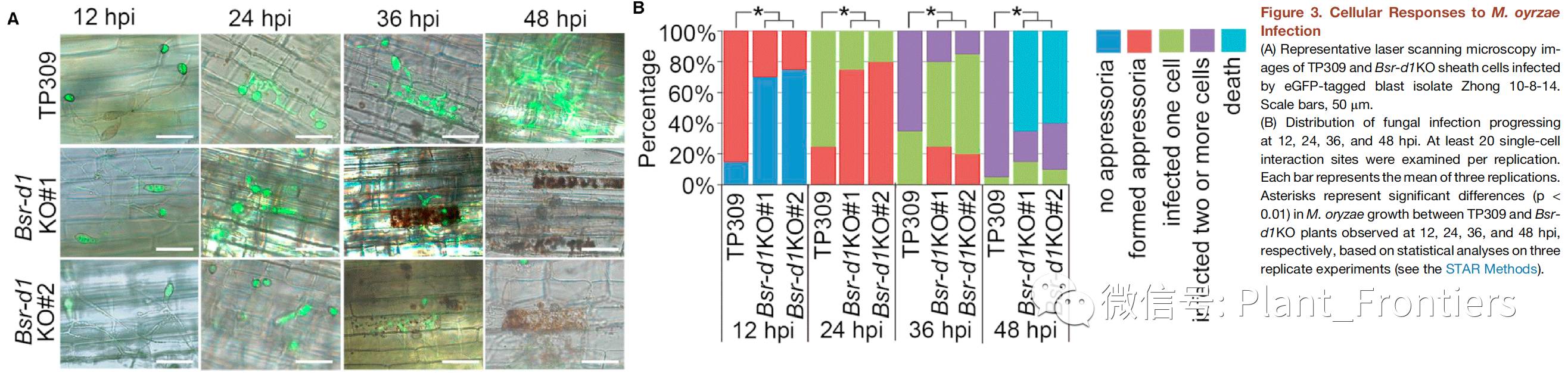
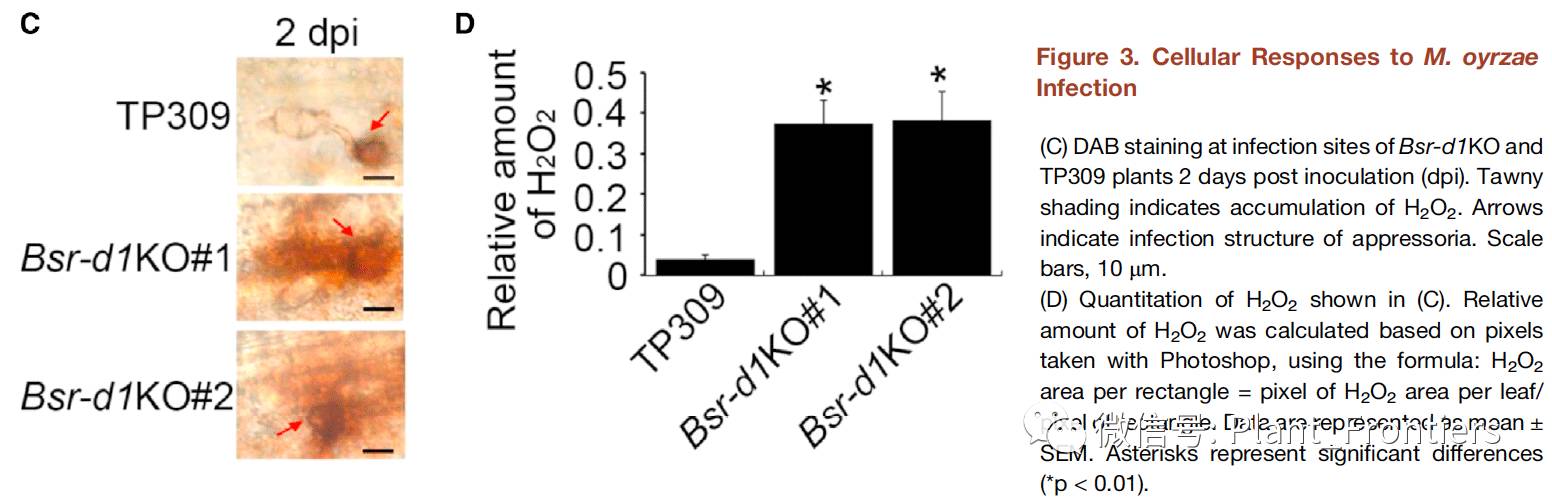
为了评估Digu中Bsr-d1基因对于稻瘟病广谱抗性程度,作者测试了Bsrd1KO株系对于除了ZB15另外的九种稻瘟病分离菌(Zhong10-8-14-eGFP,ZE-1,NC24,B04,NC10,HN41,9920-2,Guy11和FJ08-9-1)的抗性。结果显示,Bsrd1KO 株系#1和#2对于这九种分离菌均具有很强的抗性,相较于野生型TP309病变长度减少了30%–45%。接下来,作者通过eGFP标记测试了Zhong 10-8-14分离菌在野生型TP309和Bsr-d1KO株系植株鞘细胞中的生长情况。在野生型TP309中,接种后12个小时(12 hpi)附着胞形成,而这一过程在Bsr-d1KO中需要24个hpi(Figure 3A)。在野生型TP309中,侵入丝在24个hpi形成,并在36 hpi侵入邻近细胞。相反,在Bsr-d1KO中侵入丝在36 hpi衰弱,并在48 hpi消失(Figure 3A)。不同阶段的稻瘟病菌数量定量分析进一步验证了这个结果(Figure 3B)。因此,Bsr-d1基因的敲除会极大程度影响稻瘟病菌的早期生长,并在后期彻底消除稻瘟病菌。
作者还测定了细胞水平上的响应来研究由bsr-d1基因敲除介导的稻瘟病抗性的细胞内机制。通过对接种叶片使用3’,3-二氨基联苯胺(DAB)染色显示相对于野生型TP309,Bsr-d1KO接种叶片积累了更多的H2O2(Figure 3C&D),所以染色更深。与DAB染色结果一致,Bsr-d1KO株系接种鞘细胞在36-48 hpi出现过敏性坏死(HR:植物中通过局部组织过敏性坏死防止微生物病原扩散的一种机制 )。这些结果表明增高的ROS爆发是有敲除Bsr-d1介导的抗性机制一环。
-
Bsr-d1靶向在Digu受稻瘟病感染的诱导被抑制的两个过氧化物酶基因
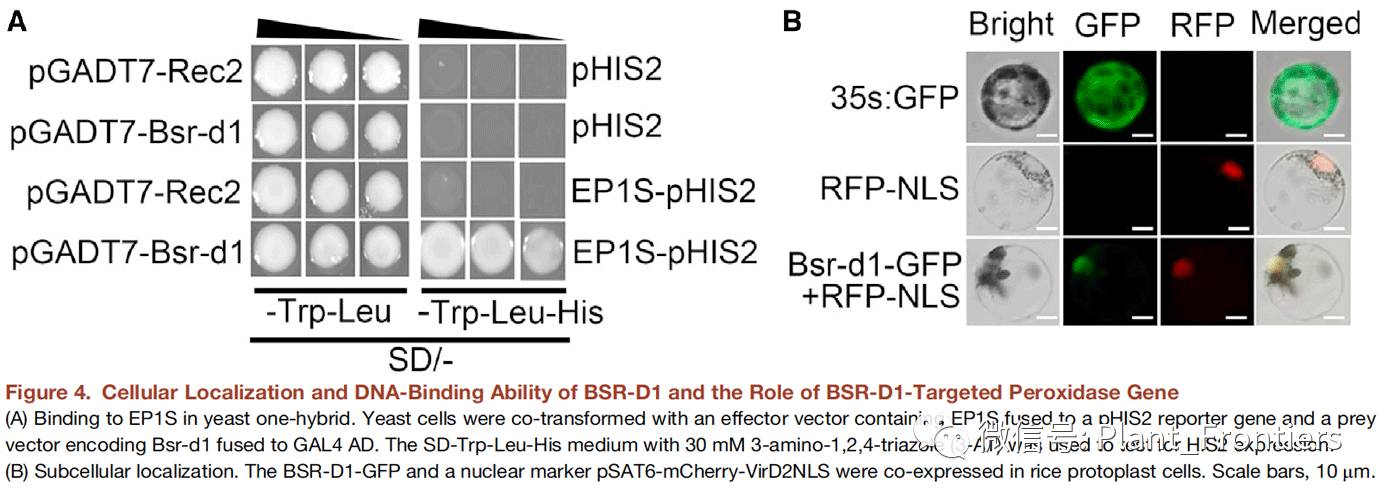
Bsr-d1编码一个C2H2类转录因子。作者通过酵母单杂试验测试BSR-D1蛋白是否会结合到含核心C2H2结合位点的EP1S序列上来判定BSR-D1蛋白是否是C2H2类DNA结合蛋白。试验结果显示,当融合GAL4激活结构域(AD)时,BSR-D1会结合到EP1S上并激活HIS2报告基因(Figure 4A)。作者还通过将BSR-D1融合进GFP蛋白对其进行亚细胞定位试验。通过RFP核定位信号(RFP-NLS),BSR-D1-GFP融合蛋白共定位于核中(Figure 4B)。因此,作者推断,BSR-D1在核中实现其转录因子的功能。
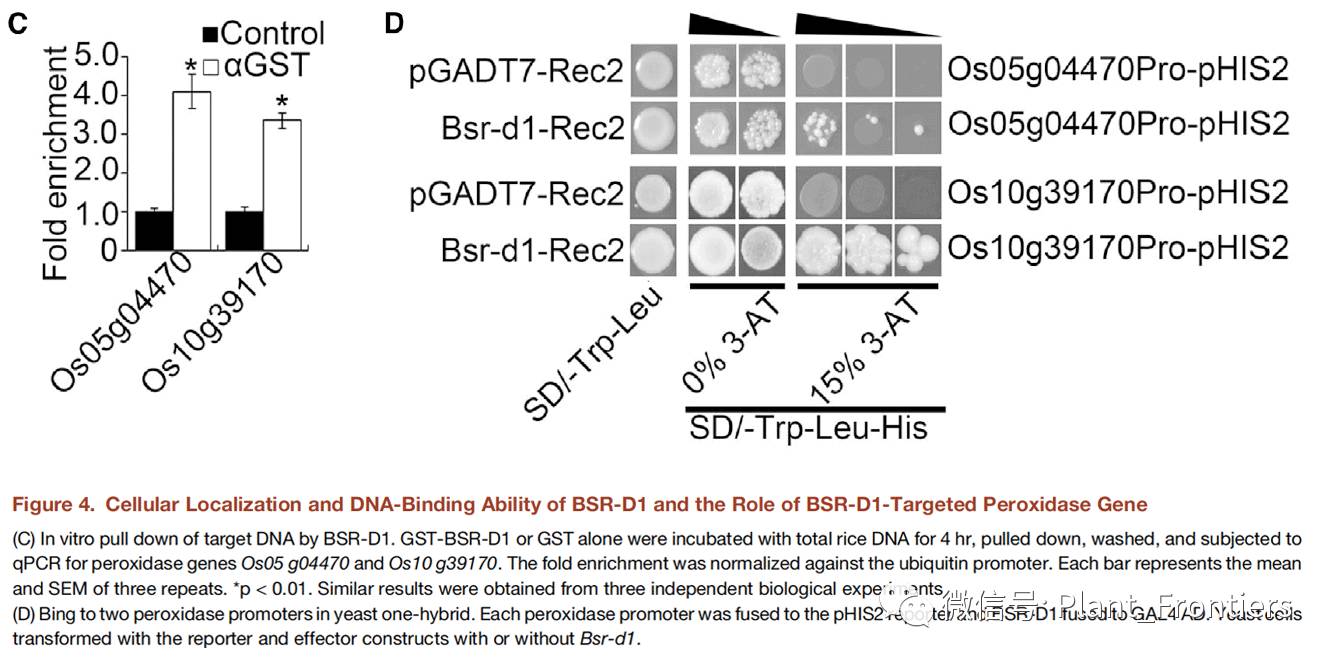
作者利用基于GST抗体和GST标记的BSR-D1蛋白进行染色质免疫共沉淀测序(ChIP-seq)试验来寻找BSR-D1蛋白的靶基因。通过这种方法,作者共鉴定了14个可能的BSR-D1蛋白的靶基因。在这14个基因排名最靠前的两个被BSR-D1蛋白拉下来的基因是两个过氧化物酶基因:Os05 g04470和Os10 g39170。作者进一步通过实时定量PCR测定这两个基因的启动子表达量来验证ChIP-seq的结果。拉下来的目标启动子是没有加抗体对照组的2.5到4倍左右(Figure 4C)。这两个过氧化物酶的启动子区均含有一个非常保守的假定C2H2结合位点。作者将BSR-D1融合进 GAL4 AD,将每个启动子融合进HIS2报告基因,然后利用酵母单杂试验来检验BSR-D1是否会结合到这两个基因的启动子区。结果显示BSR-D1结合到了每个启动子区,并激活了报告基因HIS2(Figure 4D)。因此,作者认为BSR-D1-GAL4 AD蛋白能够结合到这两个过氧化物酶的启动子区并激活它们的表达。
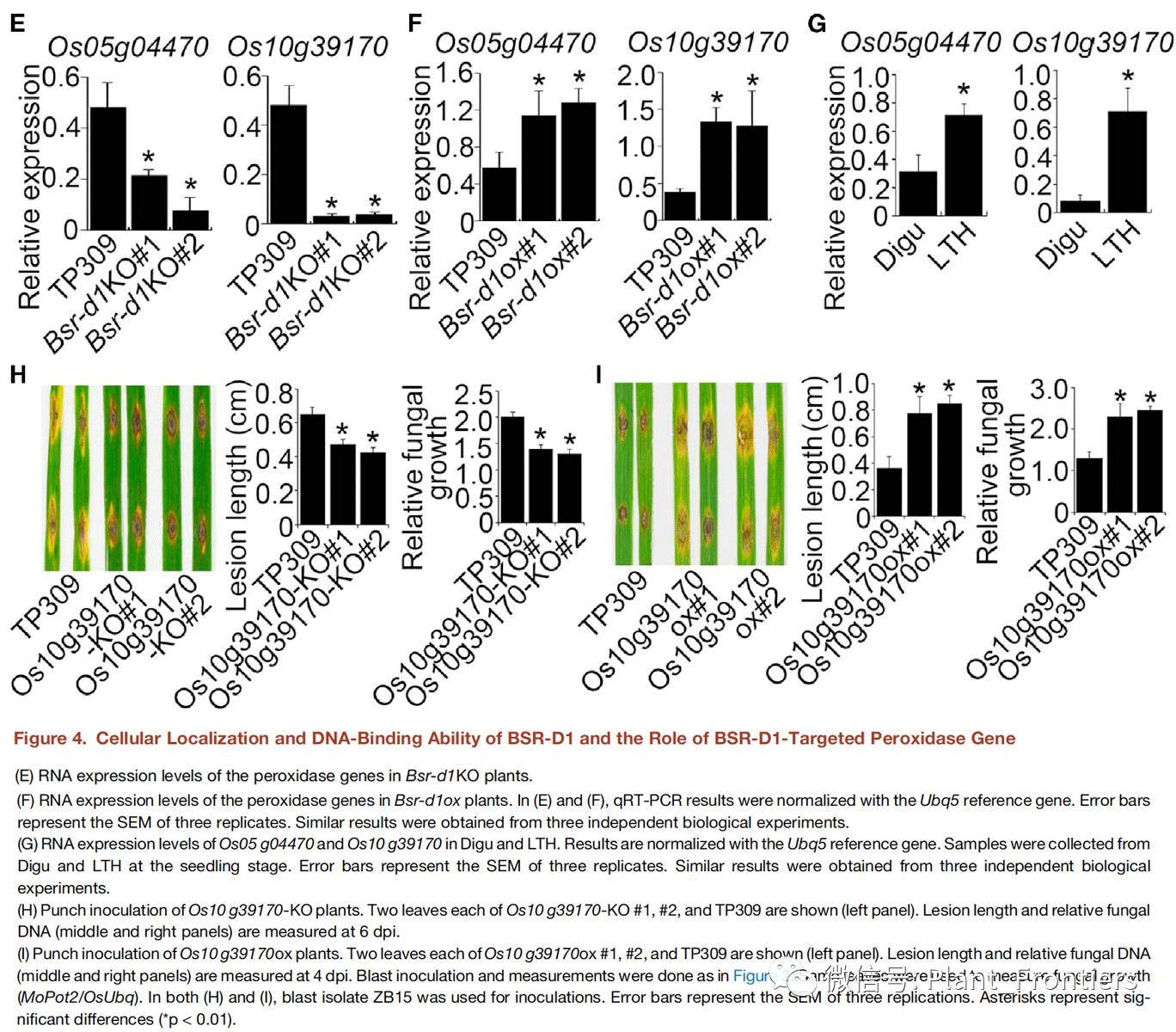
作者为了进一步确认Bsr-d1能否直接调控这两个过氧化物酶基因的表达,测量了Bsr-d1KO株系中这两个基因的表达量,结果发现表达量较野生型降低了3-8倍(Figure 4E)。相反,这两个过氧化物酶基因在过表达Bsr-d1ox株系中的表达量较野生型提高了2-3倍(Figure 4F)。这部分结果表明Bsr-d1能够直接调控这两个过氧化物酶基因的表达。所以,综上所有试验结果,作者假设在抗性品种Digu和易感品种LTH中由于不同Bsr-d1表达水平,从而对这两个过氧化物酶基因的调控有所不一样,最终赋予了Digu的稻瘟病抗性,而LTH则没有这种抗性。为了验证这个假设,作者测量了Digu和LTH中这两个过氧化物酶的表达量。结果发现,在Digu中这两种过氧化物酶基因的表达量要比在LTH中低2-8倍(Figure 4G)。作者又进一步验证了其中一个过氧化物酶基因Os10g39170的作用,该基因在TP309中更容易受到过表达Bsr-d1的诱导,且在LTH中更易受到稻瘟病菌侵染的诱导(Figure 4F&G)。相对于野生型TP309植株,敲除掉Os10g39170基因(Os10g39170-KO)的株系稻瘟病抗性增强,而过表达Os10g39170基因(Os10g39170ox)株系会更易受到稻瘟病菌的侵染(Figures 4H&I)。这些结果表明过氧化物酶基因Os10 g39170对于水稻稻瘟病菌抗性至关重要,这与Digu中高H2O2水平导致的稻瘟病抗性一致。
-
Digu和LTH中MYBS1转录因子结合到Bsr-d1启动子
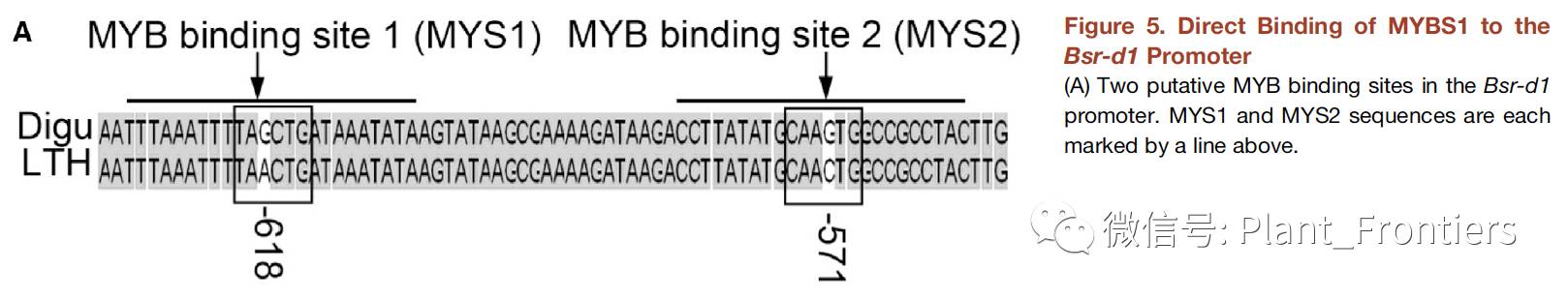
因为Bsr-d1在接种稻瘟病的Digu中表达量要比同样情况下LTH中的表达量低6倍,并且这种特性是与稻瘟病抗性息息相关的,所以作者想要鉴定出能够调节Bsr-d1基因表达的转录因子。尽管在Digu和LTH的Bsr-d1基因启动子区存在21个SNPs,然后只有2个SNPs存在于预测的转录因子结合位点上,这两个还都是MYB转录因子的结合位点(Figure 5A)。基于这些数据,作者假设MYB转录因子可以在Digu中调节Bsr-d1基因的表达,并且与LTH中不一样。因此,作者搜索了能够与Bsr-d1基因共调节且可能结合到Bsr-d1基因启动子区的MYB转录因子。作者发现了在接种稻瘟病后的Digu和LTH中4个上调和1个下调表达的MYB转录因子。作者将每个MYB转录因子分别融合进GAL4 AD,将Bsr-d1启动子融合进HIS3报告基因,利用酵母单杂试验确认哪一个MYB能够与Bsr-d1启动子结合。4个上调表达的MYB候选基因并未显著影响酵母的生长,而唯一的下调表达基因Os01g34060(简称为MYBS1)显著地降低了酵母的生长,表明MYBS1结合到了Bsr-d1启动子区并抑制其表达。
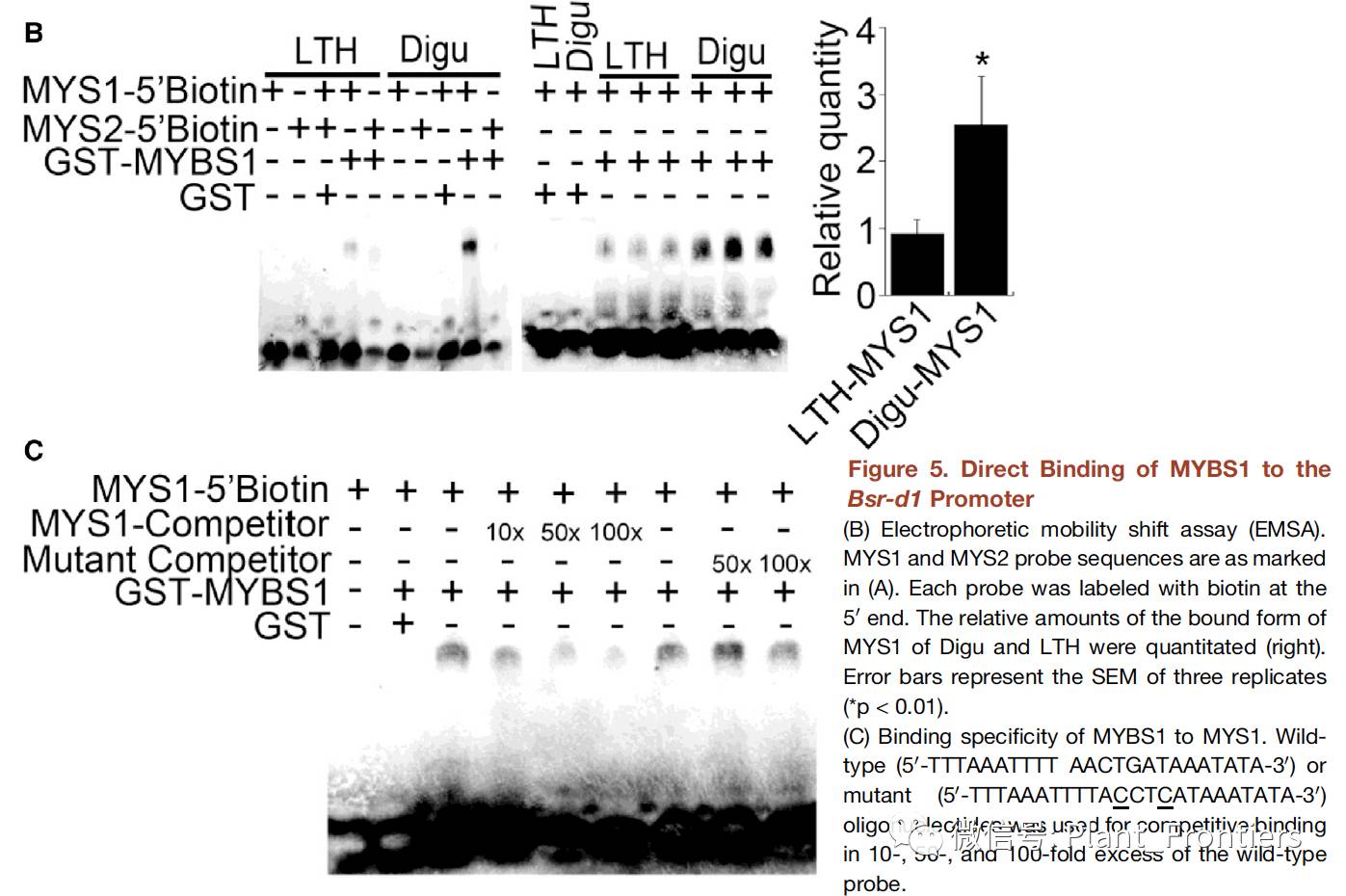
作者进一步通过电泳迁移率变换试验(EMSA)来验证MYBS1是否结合到了Bsr-d1启动子区,并确认其具体结合到那个位置上。作者在大肠杆菌中表达了MYBS1蛋白,并将其纯化作为谷胱甘肽-S-转移酶(GST )融合蛋白。至于探针,作者分别合成了含存在于Bsr-d1启动区的两个MYB结合位点(MYS1和MYS2)的生物素标记寡核苷酸(Figure 5A)。EMSA结果表明GST-MYBS1结合到MYS1上,而不会结合到MYS2上,并且来自Digu的MYS1要比来自LTH的亲和性高出很多。单独的GST并不会结合到MYS1探针上(Figure 5B)。为了进一步验证Digu MYS1具有更高的结合亲和力,作者重复了三次试验,定量结果与上述结果一致(Figure 5B)。结合的特异性通过加入竞争序列来检验,结果发现野生型的竞争序列很少结合到探针上,而突变的竞争序列有少许影响(Figure 5C)。综合以上试验结果,MYBS1可以结合到Bsr-d1基因启动子区的MYS1上,并且Digu MYS1要比LTH MYS1更具对MYBS1结合的亲和力。
-
敲除Mybs1会导致Bsr-d1表达量升高,稻瘟病菌易感性增强
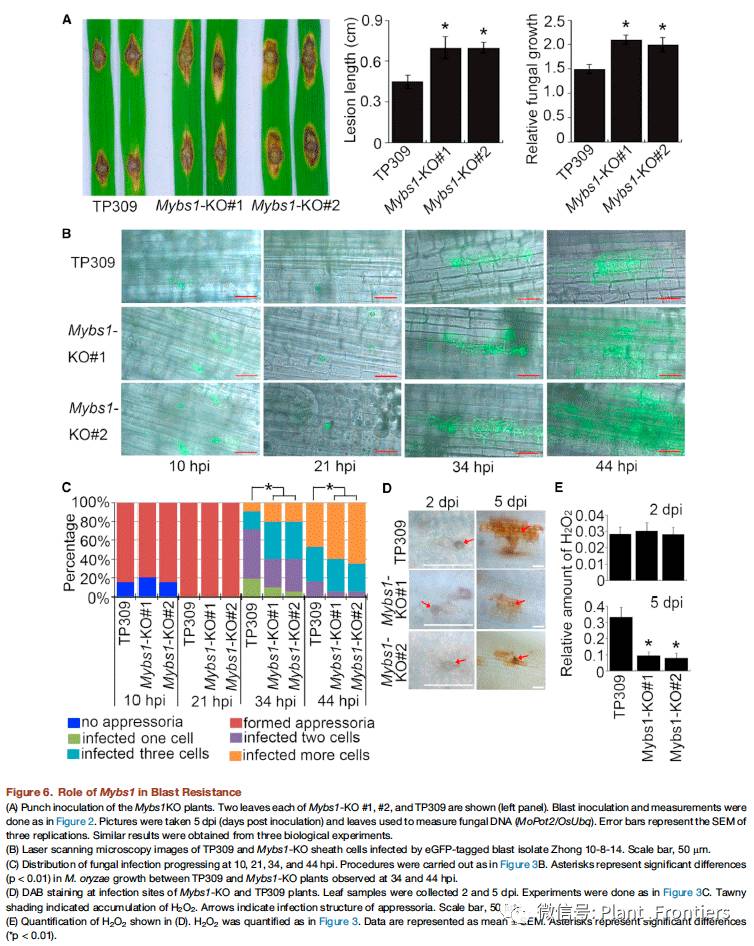
上述的研究结果表明Mybs1基因在调控的Bsr-d1基因的表达及增强水稻稻瘟病抗性方面起到重要作用。作者利用CRISPR技术获得了两个Mybs1敲除株系:Mybs1-KO #1和#2,一个具单个碱基的删除(2个株系),另一个具两个碱基的删除(5个株系),这两种突变均造成了Mybs1基因的移码突变。这些敲除株系与野生型TP309一起用离体叶片进行打孔接种稻瘟病ZB15分离菌。接种5天后,Mybs1-KO #1和#2离体叶片上的病变范围要比野生型TP309离体叶片上的大两倍。稻瘟病菌DNA定量的结果也符合预期(Figure 6A)。作者又通过向这些株系接种含eGFP标记的稻瘟病Zhong 10-8-14分离菌,然后对鞘细胞进行激光共聚焦显微镜观测。结果显示Mybs1-KO #1和#2在34和44 hpi时的侵入丝明显要比野生型TP309中生长要好。真菌生长进程的定量测量也符合显微观察结果(Figure 6B&C)。另外,DAB染色显示Mybs1-KO #1和#2株系相较于野生型TP309在接种5天后产生了更少的H2O2(Figures 6 D&E),这与其高易感性的表型一致。
接下来,作者测量了这两个Mybs1-KO株系中的Bsr-d1基因表达量,结果显示Bsr-d1 RNA水平相较于野生型提高了4-5倍。另外,两个BSR-D1靶基因(过氧化物酶基因)的表达量相较于野生野也提高了3-6倍。这些结果都符合作者之前提出的MYBS1作为Bsr-d1基因表达的负调节因子会增强水稻的抗性的假设。
然而,在接种稻瘟病菌(喷洒或打孔)后48小时内持续测量Mybs1基因的表达量发现其在Digu和LTH中都是存在先下降,再回归正常水平的趋势,并未发现明显的受稻瘟病菌诱导或在Digu和LTH中存在分化的现象。这表明,尽管Mybs1最初是因为其与Bsr-d1基因表达完全负相关而鉴定出来,然而Mybs1 RNA水平并不是Digu稻瘟病广谱抗性的主要调控机制。
Discussion
尽管全基因组关联分析(GWAS)近年来越来越多的被用于发掘与作物重要性状相关的优势自然等位基因,然后成功的案例少之又少。本文中,作者基于GWAS的方法成功鉴定了一个新颖的bsr-d1等位基因,这也是GWAS的又一个成功案例。Digu是受选择的自然水稻品种,其获得了对抗水稻稻瘟病菌的持久、广谱抗性。作者在本文中揭示了bsr-d1等位基因对于Digu的这种稻瘟病持久、广谱抗性的作用。而这对理论知识和实际应用都有重大影响。
-
稻瘟病菌招募Bsr-d1来抑制宿主免疫,促进发病
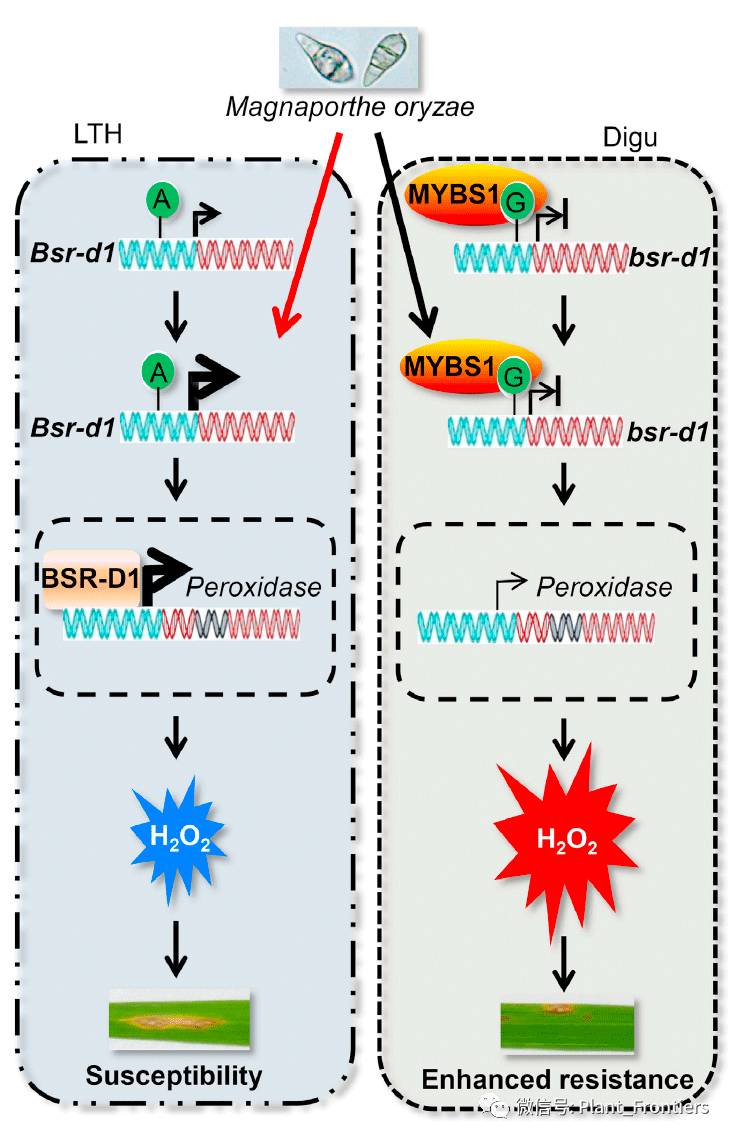
作者的研究表明,在5个易感栽培种和5个易感重组自交系中,Bsr-d1基因的表达会受到稻瘟病侵染所诱导;而在3个抗性栽培种喝5个抗性重组自交系中,Bsr-d1基因的表达则会被阻断,甚至受到抑制。作者提出了一个模型来总结所有的假设(Figure 7)。当在易感水稻栽培种中Bsr-d1的表达受到诱导时,正如在Bsr-d1过表达植株Bsr-d1ox中一样,H2O2的积累会受到抑制,从而导致宿主对于稻瘟病菌的免疫受到抑制。这个结果表明Bsr-d1作为稻瘟病菌发病的靶向基因,其目的是通过降解宿主PTI响应中产生的H2O2从而抑制宿主自身免疫。可以想象,稻瘟病菌可能会使用效应物来直接或者间接诱导Bsr-d1基因的表达。然而,作者并为鉴定到能够直接作用于Bsr-d1基因启动子区的稻瘟病效应物。水稻栽培种,如Digu,业已进化出了bsr-d1等位基因,通过抑制因子MYBS1结合到bsr-d1启动子阻断其受稻瘟病的诱导来对抗稻瘟病(Figure 7)。因此,作者在本文中新揭示了一种稻瘟病抑制宿主自身免疫和宿主进化出抗争稻瘟病的分子机制。
-
BSR-D1和MYBS1是调控植物免疫新的转录因子
参与植物免疫反应的转录因子大概可分为五个家族:WRKY,ethylene responsive factor/APETALA2 (ERF/AP2),basic-domain leucine-zipper (bZIP),basic helix-loophelix (bHLH和NAM/ATAF/CUC (NAC)。另外,分属于CCCH,SPL和MYB家族的C2H12,NbSPL6和MYB30也会参与植物免疫。
大多功能阐明较好的参与植物免疫的转录因子属于WRKY家族。OsNAC111和OsERF922是两个研究的较为透彻的非WRKY家族的转录因子。BSR-D1并为通过OsERF922或者OsNAC111来调控植物免疫,因为Bsr-d1KO并为影响OsERF922或者OsNAC111的表达。BSR-D1含有一个C2H2结构域,代表了一类参与植物免疫反应的新的转录因子家族。
MYBS1属于MYB家族的转录因子,在Digu中抑制bsr-d1基因的表达,从而提高Digu对于稻瘟病菌的抗性。尽管,MYB转录因子曾被报道通过调解其他转录因子来调控其它生物学进程,但从未有报道显示MYB转录因子在植物免疫中通过调节其它转录因子扮演着非常重要的角色。本文显示了MYB家族的一个转录因子是如何参与到植物免疫中的。
-
bsr-d1可能通过调控过氧化物酶的积累来赋予Digu稻瘟病持久、广谱抗性
Bsr-d1KO会导致H2O2在侵染部位积累,更重要的是,会像在Digu中一样对稻瘟病菌产生持久、广谱抗性。这种特性不同于R基因介导的抗性,R基因介导的抗性通常会受限于几个带有相应Avr蛋白的特异小种。与由R基因介导的小种专化抗性相比,非小种专化抗性通常更加持久。比如说,由pi21(一个非R蛋白)赋予的稻瘟病抗性是非小种专化抗性且更加持久。作者假设由bsr-d1赋予的稻瘟病菌抗性可以像在Digu中一样具有持久抗性。
Bsr-d1KO植株,像Digu植株一样,通过调节H2O2的积累对稻瘟病菌产生免疫 (Figures 3&7)。包括H2O2和过氧化物在内的ROS在信号转导过程中作为第二信使,会激活基因的表达,酶活性以及免疫响应。NADPH氧化酶,又称为呼吸爆发氧化酶同系物(RBOHs),产生大多数的ROS。水稻中,9个RBOHs中的3个(OsRbohA,OsRbohB和OsRbohE)已被报道通过增加H2O2来赋予水稻对稻瘟病菌的抗性。这三个基因的表达在Bsr-d1KO植株中不受影响。Bsr-d1好像更倾向于通过抑制H2O2的降解而非增加其产量来积累H2O2。因此,bsr-d1并不依赖于OsRboh的转录诱导来获取免疫响应的增强。
过氧化物酶,如过氧化氢酶和抗坏血酸过氧化物酶,会降解H2O2。拟南芥中有73个过氧化物酶基因,而水稻中则有138过氧化物酶基因。抑制烟草中的过氧化氢酶1或者过氧化氢酶2会促进H2O2的积累,进而提高PR1蛋白和水杨酸的水平,增加烟草对花叶病毒的抗性,显示了高H2O2含量与免疫响应激活之间直接的联系。最重要的是,本文的研究结果显示过氧化物酶基因Os10 g39170会直接参与到水稻对稻瘟病菌的抗性(Figure 4H&I)。
-
bsr-d1介导的稻瘟病抗性在育种中的应用
尽管典型的Pi基因赋予水稻对稻瘟病菌的强力抗性,整合多个Pi基因以此获取对稻瘟病的广谱抗性十分费时,并不是一个对抗进化迅速的稻瘟病的有效途径。尽管,目前已经有超过28个Pi基因已经被分离出来,然而除了Pid2和pi21,所有的Pi基因都属于NBS-LRR家族基因。Pid2基因编码一个β-凝集素类受体激酶;pi21基因编码一个含金属结合结构域且富含脯氨酸的蛋白。和pi21基因类似,bsr-d1也赋予了非小种专抗的稻瘟病广谱抗性,为作物育种提供了一个非常优良的抗病特性。有趣的是,pi21和bsr-d1基因都是鉴定为自然水稻品种中的变异等位基因,其抑制植物免疫响应的基因出现功能缺失突变。
然而,bsr-d1基因要比pi21基因具有更加优良的特性。pi21基因已知与不良性状基因LOC_Os04 g32890连锁,该基因会导致水稻的味道和品质下降,尤其还会引起水稻垩白粒。而这将花费育种者们巨大的心血来将这两个基因进行分离。相反,位于3号染色体上的bsr-d1基因就没有跟任何已知与水稻品质或风味性状关联基因连锁。所有以报道的控制水稻垩白粒的QTLs均存在于水稻1、2和4-12号染色体上;没有一个是在3号染色体上的。作者的测量数据表明,在Bsr-d1KO株系和野生型栽培种之间不存在重要农艺性状上的差异。甚至于,Bsr-d1KO株系的籽粒还会不知为何地胚乳白垩程度较低。因此,bsr-d1基因为水稻的抗性育种提供了一个更好的遗传资源。
通过调节植物抗性相关基因来增强植株疾病抗性通常会带来植株生长方面的妥协。比如,拟南芥中SRFR1或者BAK1突变会造成矮化,SPL28的突变虽然能够增加对稻瘟病的抗性,但会导致籽粒产量和品质上的下降。相反,bsr-d1基因介导的稻瘟病抗性增强并未对植株生长或籽粒产量造成明显的影响。这有可能是由于bsr-d1等位基因已经是在自然条件下受到选择,进化为最适合环境变化和育种的结果。事实上,作者通过对3000份的水稻基因组重测序进行分析发现bsr-d1等位基因在分布在26个国家313个水稻品种中均存在,尤其是在东南亚地区的水稻品种。这些结果表明,这种对抗水稻稻瘟病的分子机制已经在某些地区的育种进程中不知道该等位基因的情况下受到了选择。然而,这个等位基因仅出现在10%的水稻品种中,因而还存在一个非常大的潜力,将该天然等位基因引入到其它的水稻品种中去。
通讯:陈学伟
四川农业大学水稻研究所特聘教授,1997年、2000年毕业于四川农业大学,先后获得学士和硕士学位,于2003年在中国科学院获得遗传学博士学位,后在中国科学院遗传与发育生物所从事一年研究工作。于2004年赴美国加利福利亚大学国际著名实验室从事水稻抗病分子机理研究和应用工作7年。于2011年回国就职于四川农业大学水稻研究所继续从事水稻重大病害理论与应用研究。
doi: https://doi.org/10.1105/tpc.17.00153
Journal: Cell
Published data: June 29 2017.