基因疗法近期新研究进展一览
来源:;基因疗法
7月12日,位于美国马里兰州的再生医学公司TissueGene表示,公司亚洲地区(包含韩国)独占性许可商Kolon Life Science收到了韩国食品药品安全部(MFDS)针对世界首个退行性关节炎治疗的细胞及基因疗法Invossa-K Inj(Invossa™)的上市批准决定。
对于世界上首个用于膝骨关节炎治疗的细胞及基因疗法在韩国获得批准,使得该疗法具有成为全球第一个改善疾病的骨关节炎药物(DMOAD)的潜力。这次获批是该创新细胞及基因疗法在全球上市进程中的首次关键性进展,该创新疗法可以应对临床需求仍未满足的,严重影响数百万患者的骨关节炎领域的治疗挑战。
基因治疗是一种将外源正常基因导入靶向目标(细胞等),以纠正或补偿因基因缺陷或异常引发的疾病,从而达到治疗多种疾病的目的。除了骨关节炎外,早期临床试验结果表明,基因疗法在治疗白血病、血友病、地中海贫血、帕金森症、阿尔茨海默病等上效果显著,甚至能够令盲人重获光明,而更多的动物模型试验显示,基因治疗大有根治更多顽疾的可能。这里梅斯小编整理了近期关于基因疗法的新进展与大家一同分享。
【1】NEJM:基因疗法可有效治疗镰刀型红细胞贫血症
近期发表于NEJM的一项研究中,研究者们发现一种新的基因疗法,能够有效治疗镰刀型红细胞贫血症。
虽然这一疗法仅仅在一名法国青少年身上成功实现,但这一手术释放了一个非常积极的早期信号,或许能够推广给数百万名患有该种疾病的患者。
不过,科学家们通过病毒转染的方式将正常的血红蛋白基因转入这名患者的骨髓细胞中并将其回输到患者体内。经过15个月的治疗,患者的健康水平得到了大幅上升,已经可以不依赖药物治疗。虽然现在就说得到了治愈还为时尚早,但作为前期的探索性治疗,这一病例已经取得了巨大的成功。
目前有效的疗法只有骨髓移植,但这一疗法不仅风险高,而且手术十分困难,并不是所有人都适用。由于该种疾病是因为血红蛋白基因的一个核苷酸发生突变引起的,因此理论上通过基因疗法扭转这一突变的影响后就能够得到治愈。(文章详见——NEJM:基因疗法可有效治疗镰刀型红细胞贫血症)
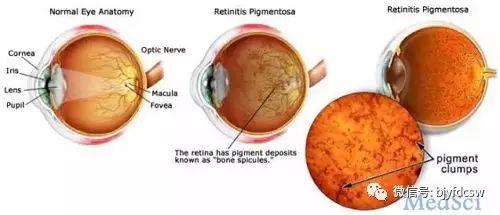
【2】Lancet:牛津眼科专家最新基因疗法点亮了遗传性失明患者的世界
3月20日,NightstaRx公司宣布开始基因治疗X-linked色素性视网膜炎的I / II阶段的临床试验,这是NightstaRx公司的第二个在患者中测试的AAV候选产品。NightstaRx则是一家旨在开发帮助遗传性视网膜营养不良症的患者的基因疗法,正处于临床研究阶段的生物技术公司,总部位于英国。
早在2014年1月,该公司与牛津大学合作研发出了主要针对无脉络膜症患者的基因治疗药物—AAV2-REP1。该药物是由牛津大学Nuffield眼科实验室Robert MacLaren 教授开发的治疗遗传性进行性失明疾病无脉络膜症的基因疗法。临床试验的治疗已经显示出可喜的成果,结果发表在《柳叶刀》杂志上。这种方法是使用一个称为腺相关病毒(AAV)病毒载体传送一个Rab-escort蛋白1(REP-1)基(AAV2-REP1)野生型副本到无脉络膜患者的视网膜细胞。该研究目前还在正在进行,接下来的6名患者接受更高剂量。公司将很快公布其III期研究计划。
针对公司的第二个AAV候选产品,已经开始招募和治疗受试者进行I / II期临床试验,这是全球XLRP类型的第一次临床试验,并且从许可进展到临床试验仅仅用了18个月的时间。
就在上周四,一名29岁的男性成为世界上第一个在牛津眼科医院接受手术的人,现在正在康复中。
NightstaRx公司所开发的基因治疗方法的是使用腺相关病毒(AAV)的载体将色素性视网膜炎GTP酶调节剂(RPGR)基因的密码子优化的拷贝递送到眼细胞中,这是第一次用于临床测试。(文章详见——Lancet:牛津眼科专家最新基因疗法点亮了遗传性失明患者的世界)
【3】JCI:中国科学家利用基因疗法成功逆转 I 型糖尿病进程
中国研究人员 4 日报告说,他们运用基因治疗技术,让 1 型糖尿病小鼠体内产生大量欧米茄 - 3 脂肪酸,成功逆转疾病进程。这为治愈饱受 1 型糖尿病折磨的患者带来了新希望。这项由广东工业大学赵子建及李芳红两名教授领军完成的研究发表在新一期美国《临床检查杂志》上。
研究人员从国外多年的临床研究中得到启示:有 1 型糖尿病遗传家族史的婴幼儿在断奶后长期服用深海鱼油,可以显着降低 1 型糖尿病的发病风险。但他们也发现,如果想通过补充鱼油逆转自身免疫失衡和糖尿病发展进程,需要的剂量大幅超出目前临床许可的剂量,在现实中难以实现。
为此,研究人员通过基因治疗手段表达一种特异的酶,使得小鼠体内能够产生大量欧米茄 - 3 脂肪酸 EPA 和 DHA。
结果显示,这种新疗法矫正了自身免疫系统失衡,逆转了 1 型糖尿病的发展进程。血液中的胰岛素回归到正常水平,血糖也降低到正常范围,胰腺中还出现大量新生的分泌胰岛素的胰岛细胞。这意味着,新疗法可帮助实现长期血糖稳定,让患者彻底摆脱对外源胰岛素的依赖。(文章详见—— JCI:中国科学家利用基因疗法成功逆转 I 型糖尿病进程)
【4】Nature:针对II型脊髓小脑性共济失调的基因疗法
在最新上线的Nature杂志中,来自美国犹他大学的Daniel R.Scoles及其同事报导了他们运用人工合成的核苷酸降低ATXN2蛋白的表达量,从而达到改善和治疗II型脊髓小脑性共济失调的目的。
研究组首先在体外细胞实验中筛选了152种人工合成的反链核苷酸,然后发现其中有8种反链核苷酸能将ATXN2蛋白的表达量降低至少85%。在这之中,又有3种反链核苷酸能够持续抑制ATXN2蛋白的表达长达一周,并且不会显著的激活神经组织中的小胶质细胞。
研究组接着在两种II型脊髓小脑性共济失调小鼠模型中测试了一种反链核苷酸的疗效。研究组将反链核苷酸直通过脑室注射。发现反链核苷酸能够进入小脑皮质的浦肯野细胞,并且降低ATXN2蛋白的表达量达10周之久。直射后,浦肯野细胞的电极激活频率和运动能力都达到了正常水平。这项研究为治疗由于ATXN2基因缺陷所导致的II型脊髓小脑性共济失调提供了新的方向。(文章详见——Nature:针对II型脊髓小脑性共济失调的基因疗法)
【5】LANCET:新的基因疗法有望治疗黄斑病变
5月16日在《柳叶刀》上发表的研究报道了一种令人兴奋的新方法,科研人员利用不能引起疾病的病毒作为基因载体,注入眼睛。病毒穿透视网膜细胞并沉积一个基因,将基因转化为工厂,用于生产名为sFLT01的治疗性蛋白质。
1期临床试验涉及19名男性和女性,他们均为50岁以上的AMD患者。参与者被分为五个不同的组,研究人员检查各组至少4周的不良反应迹象,然后再向下一组施用较高剂量。病毒沉积基因后,细胞开始分泌与VEGF结合的sFLT01,阻止其刺激异常血管的渗漏和生长,目标是感染病毒的视网膜细胞可以产生足够的sFLT01以永久停止AMD的进展。
在监测前三组发现无剂量限制性毒性后,研究人员对10名参与者进行了最大剂量治疗,未发现严重副作用。研究人员表示,即使是最高剂量,治疗也是相当安全的,我们发现我们的患者几乎没有不良反应。
结果显示,在十一名患者中,四人显示出显着的改善。 Campochiaro说,眼睛中的液体量从下降明显到几乎没有,就像最佳标准治疗所观察到的那样。此外,另外两名参与者显示眼睛液体量的部分减少。五名参与者显示没有降低液位。令人惊讶的是,研究人员说,他们发现所有没有改善的患者都有预先存在的抗AAV2病毒的抗体。(文章详见——LANCET:新的基因疗法有望治疗黄斑病变)
【6】JCI Insight:新基因疗法或将彻底拯救过敏患者
澳大利亚昆士兰大学的一项免疫学研究开发出一种新基因疗法,能够让严重过敏和哮喘患者“一劳永逸”。该研究已发表在《JCI Insight》上。
由昆士兰大学Diamantina研究所助理教授Ray Steptoe领导的一个研究团队能够“关闭”导致动物过敏反应的免疫反应。
研究人员采集了造血干细胞,插入调节过敏原蛋白质的基因,再把这些细胞注入受体。这些基因工程细胞将生成新的血细胞,其表达的蛋白质靶向特定的免疫细胞,从而‘关闭’免疫反应。
最终的目标是,使用一种简单的基因注射疗法来代替以过敏症状为靶标的短期治疗方法,因为这些传统的治疗方法效果参差不齐。(文章详见——JCI Insight:新基因疗法或将彻底拯救过敏患者)
【7】Stroke:可溶性FLT1基因治疗可以减轻脑动静脉畸形的严重程度
近日,卒中领域权威杂志Stroke上发表了一篇研究文章,研究人员验证了通过静脉输入腺相关病毒载体血清型-9表达可溶性FLT1(AAV9-sFLT1)可以缓解bAVM的表型。
研究人员采用了两种小鼠模型。在模型1中,在R26CreER小鼠诱导bAVM;Eng2f/2f小鼠通过全身Eng基因敲除和大脑局灶性脑血管刺激;在模型诱导的时间将AAV2-sFLT02(AAV表达更短的sFLT1)注射入脑内,8周后静脉注射AAV9-sFLT1。在模型2中,SM22αCre;Eng2f/2f小鼠在5周龄有90%发生自发性的bAVM在6周时有50%的死亡率;AAV9-sFLT1通过静脉输送到4至5周龄的小鼠。在AAV9-sFLT1输入4周后和收集组织标本。
研究人员发现AAV2-sFLT02可以抑制bAVM的形成,并且AAV9-sFLT1可以减少模型1动物的血管异常。在模型2的小鼠中,AAV9-sFLT1可以减少bAVM的发生和死亡率。肾、肝功能无明显变化。在接受AAV9-sFLT1处理的模型1小鼠中56%的小鼠存在轻微的肝脏炎症。(文章详见——Stroke:可溶性FLT1基因治疗可以减轻脑动静脉畸形的严重程度)
【8】STM:基因治疗-重建受伤骨骼!
近日,美国希德斯-西奈(Cedars-Sinai)医疗中心的研究人员通过创新技术成功地修复了实验动物的严重肢体骨折,帮助这些骨骼组织无法自愈的动物重新长出了自己的骨骼组织。目前,研究人员已经证实了这种方法对于人类患者的安全性与有效性。结合超声疗法,干细胞技术与基因治疗技术,这种开创性的治疗方法最终可以取代骨组织移植作为修复严重破骨的有效方法。
研究人员构建了一个胶原蛋白基质模型,胶原蛋白是人们身体内合成骨骼的重要原料。科学家将这种胶原基质植入实验动物腿骨骨折两侧的间隙并在两周的时间内将实验动物自身的骨骼干细胞引入了骨裂缺口。为了启动骨骼的修复过程,该团队将促进骨骼细胞生长和分化基因导入动物骨骼干细胞中,利用超声脉冲和微泡将骨诱导基因直接递送到了干细胞中。
在手术实施8周后,所有接受治疗的实验动物都发生了与正常骨骼移植没有明显差别的愈合。研究表明,这些介导生长的骨骼与手术移植的骨骼一样强壮。(文章详见——STM:伟大革命开始!基因治疗踏足骨科----重建受伤骨骼!)